|
eau oxygénée ; savon ; scanographie bac SMS Polynésie 2007. |
|||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||
|
Masse molaire du peroxyde d'hydrogène MH2O2=34 g/mol ; volume molaire dans les CNTP : Vm=2,4 L/mol. L'eau oxygénée est une solution utilisée pour ces propriétés antiseptiques. On relève l'étiquette d'un flacon de cette solution pour y lire les indication suivantes :
Indiquer la formule chimique du peroxyde d'hydrogène. H2O2. Donner la définition du titre en volume d'une eau oxygénée. Le titre d'une eau oxygénée exprime le volume de dioxygène (mesuré en L dans les conditions normales de température et de pression) que peut libérer un litre d'eau oxygénée. Quel est le volume de dioxygène susceptible de se dégager à partir d'un volume V=1 L de cette solution ? 10 L.
125 mL = 0,125 L ; 10*0,125 = 1,25 L
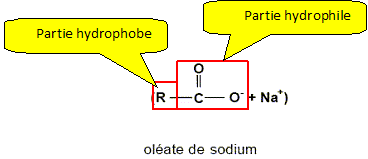
Savon. La fabrication du savon date de l'antiquité et repose sur la réaction entre un corps gras et une solution concentrée de soude. Pour la préparation du savon de Marseille, le corps gras utilisé est l'oléine provenant de l'huile d'olive. L'équation de fabrication de ce savon s'écrit :
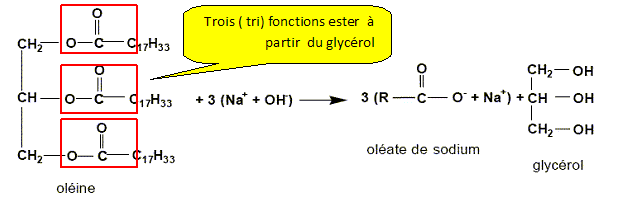
Quel esl le nom de cette réaction ? saponification, hydrolyse basique. La réaction est-elle partielle ou totale ? totale. Entourer les groupes fonctionnels caractéristiques "ester". Justifier le nom triglycéride donné à l'oléine.
Définir hydrophile et hydrophobe. hydrophile : ami de l'eau ; hydrophobe : qui n'aime pas l'eau. Sur la formule de l'ion carboxylate, identifier ces 2 pôles.
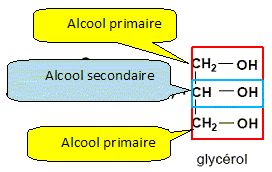
En utilisant l'équation, identifier le groupe R parmi les groupes suivants : CH2 ; CH ; CH2-CH-CH2 ; C17H33. R est une longue chaîne carbonée : C17H33. Une mole d'oléine conduit à trois moles de savon. Calculer la masse de savon formé à partir d'une mole d'oléine. masse molaire de l'oléate de sodium ( savon) M= 304 g/mol. m = n M ; n = 3 moles ; m = 3*304 = 912 g. Le second produit de la réaction est le glycérol. Citer la ou les fonction(s) chimique(s) présente(s) dans la formule du glycérol.
Scannographie. Les rayons X sont utilisés en scanographie et en radiographie. Contrairement à la raiographie, la scanographie consiste à mesurer la quantité de rayonnement absorbé par les tissus en calculant la différence d'intensité des rayons avant et après la traversée des tissus. A partir de ces informations, un ordinateur fourni une image spatiale de l'organe étudié. Afin d'améliorer la qualité de l'image, on utilise systématiquement des produits de contraste iodés. Le scanner est devenu un dispositif médical indispensable, complémentaire et substitutif pour certains examens de la radiographie classique. En ce qui concerne le système nerveux, la scanographie est concurencée par l'IRM. Les doses de rayons X utilisés en scannographie sont plus faibles que celles utilisées lors des examens radiologiques classiques. La scanographie est donc moins dangereuse que la radiologie mais son pouvoir de résolution est nettement inférieur. La scannographie provoque une certaine irradiation de l'organisme, et il faut l'éviter chez la femme enceinte. Pouvoir de résolution : ce qui permet de distinguer les détails. Les rayons X sont des ondes électromagnétiques de même nature que la lumière. Cette affirmation est-elle vraie ou fausse ? vraie. Citer une source de rayons X. tube de Crookes . On a représenté sur l'axe ci-dessous les limites des différents types d'ondes électromagnétiques. Compléter les deux cases.( les réponses sont écrites en rouge)
Quel autre dispositif médical n'utilisant pas les rayons X est citer dans le texte ? IRM. La relation liant la fréquence n ( en hertz Hz) d'un photon à sa longueur d'onde l ( en mètre, m) est donnée par la relation n = c/l. Que représente la lettre c ? Quelle est son unité ? vitesse de la lumière dans le vide, exprimée en m /s (m s-1). Rappeler la relation liant l'énergie E d'un photon et sa fréquence n. Quelle est l'unité de l'énergie ? E = h n. L'énergie s'exprime en joule (J). Recopier en supprimant les mots inutiles la phrase suivante : L'énergie d'un photon est plus ( grande ou petite) lorsque sa fréquence est plus ( grande ou petite) ou sa longueur d'onde plus ( grande ou petite). E = h n = E = h c / l. L'énergie d'un photon est plus grande lorsque sa fréquence est plus grande ou sa longueur d'onde plus petite. L'énergie d'un photon est plus petite lorsque sa fréquence est plus petite ou sa longueur d'onde plus grande.
A propos de l'iode. L'iode est un élément chimique dont le symbole est 12753I. Indiquer la composition du noyau d'iode ( neutrons et protons ). 53 protons ; 127-53 = 74 neutrons. Les tissus du corps humain sont constitués essentiellement des éléments carbone (Z=6), hydrogène (Z=1), oxygène (Z=8) et azote (Z=7). l'élément iode est caractérisé par Z=53. Lequel de ces éléments absorbe le plus les rayons X ? Justifier. Un atome absorbe d'autant plus les rayons X que son numéro atomique Z est élevé ; réponse : élément iode. Citer deux effets sur l'organisme d'une exposition répétée et prolongée aux rayons X. Les rayons X ont un fort pouvoir ionisant sur les tissus biologiques donc, plus la dose est importante plus le nombre de cellules détruites est élevé. Effets biologiques possibles sur le corps humain, après une exposition prolongée : cancers, stérilité ; mutations biologiques ; malformations du fœtus chez la femme enceinte, leucémies Comment un manipulateur radio se protège t-il des rayons X ? - s’éloigner de la source de rayonnements - mettre un ou plusieurs écrans entre la source de rayonnements et les personnes. (des parois en plomb). - diminuer au maximum la durée de l’exposition aux rayonnements.
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||
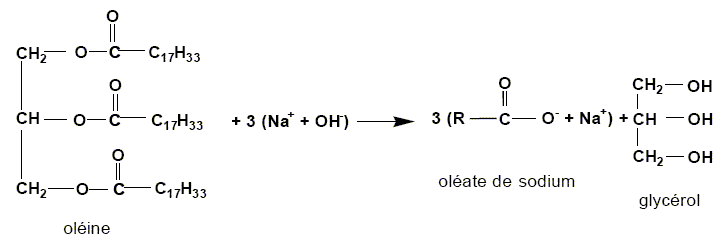
 .
.