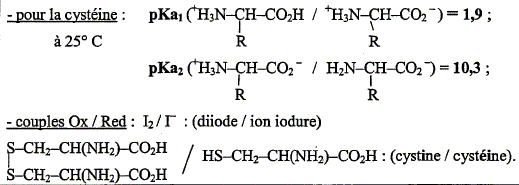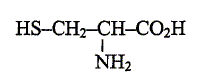|
Acide aminé : la cystéine ; appareils UV et produits filtrants : BTS esthétique cosmétique 08 En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Les kératines sont présentes dans l'épiderme, les ongles mais aussi dans les poils des cheveux. Données : masses atomiques molaires (
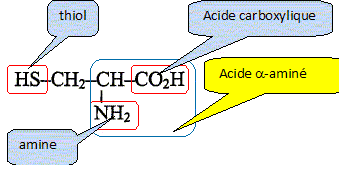
g/mol) : H : 1 ; C : 12 ; O : 16 ; S : 32. Ce sont des protéines issues de la condensation d'un grand nombre de molécules d'acides a-aminés, comme la cystine et la cystéine. La cystine et la cystéine sont utilisés comme produits fortifiants. On s'intéresse ici à un médicament ne contenant que la cystéine comme fortifiant. Etude des structures : On donne la formule de la cystéine : Repérer et nommer chacun des trois groupes caractéristiques( ou fonctionnels) qu'elle contient.
Justifier que cette moléxule se présente sous forme de deux énantiomères. Comment qualifie t-on cette molécule ? - le carbone en alpha du groupe CO2H
est tétragonal. - il porte quatre groupes d'atomes
différents : H ; CO2H ;
NH2 et CH2-SH. La molécule est
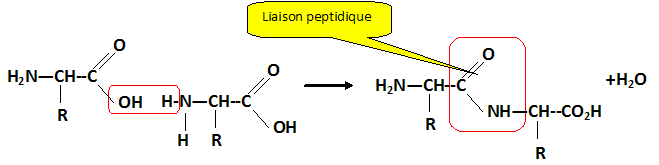
chirale. Ecrire l'équation de la réaction de condensation entre deux molécules de cystèine. Indiquer le nom de la liaison qui s'est formé au cours de cette réaction. Quel est le groupe caractéristique correspondant ?
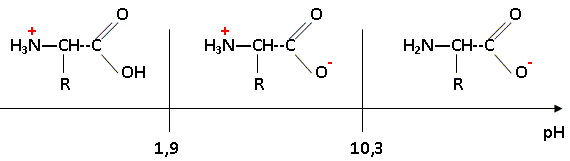
On considère maintenant une solution aqueuse de cystéine de concentration usuelle. Donner les formes que peut prendre la molécule de cystéine dans l'eau en fonction du pH de la solution. Tracer un diagramme de prédominance.
Quel est le nom général de l'espèce prédominante dans le domaine [1,9 ; 10,3] de pH ? Quelle est sa propriété acido-basique ? Préciser la signification de cette propriété ? La cystéine se trouve essentiellement sous forme de zwitterion ou amphion H3N+-CHR-COO- noté AH(+ -). On lui associe deux constante d'acicité pKa1= 1,9 ( associé au groupe acide carboxilique) et pKa2= 10,3 ( associé au groupe amine). Un zwitterion possède une valeur de pH caractéristique pour laquelle il est sous la forme zwitterionique globalement neutre : c'est le pH isoélectrique On obtient une solution tampon au voisinage du pH isoélectrique. Le pH varie peu en cas de dilution modérée, ou en cas d'ajout d'une quantité limité de H+ ou de OH-. En déduire le pH de cette solution aqueuse, de concentration usuelle. pH = ½(pKa1+pKa2) = 0,5(1,9+10,3) ; pH = 6,1.
La cystéine HO2C-CH(NH2)-CH2-SH s'oxyde facilement, par exemple en présence d'une solution aqueuse de diiode, en cystine de formule : HO2C-CH(NH2)-CH2-S-S-CH2-CH(NH2)-CO2H. Ecrire les deux demi-équations ( électroniques) correspondantes ainsi que l'équation associée à la réaction ( équation bilan). I2 + 2e- = 2I- réduction 2 HO2C-CH(NH2)-CH2-SH =HO2C-CH(NH2)-CH2-S-S-CH2-CH(NH2)-CO2H + 2H+ + 2e- oxydation I2 + 2 HO2C-CH(NH2)-CH2-SH =HO2C-CH(NH2)-CH2-S-S-CH2-CH(NH2)-CO2H + 2H+ +2I- oxydoréduction. Pour doser le produit fortifiant, on fait réagir la cystéine avec une solution aqueuse de diiode de concentration molaire 2,50 10-3 mol/L. Quel volume de la solution de diiode faut-il verser pour oxyder complètement 11 mg de cystéine ? Masse molaire de la cystéine C3H7O2NS : M = 3*12+7+2*16+14+32=121 g/mol Quantité de matière de cystéine = masse (g) / masse molaire (g/mol) = 0,011/121 = 9,09 10-5 mol. D'après l'équation bilan ci-dessus, 1 mole de diiode réagit avec 2 moles de cystéine : 0,5 mol de diiode réagit avec 1 mole de cystéine ; 9,09 10-5 *0,5 = 4,55 10-5 mol de diiode réagit avec 9,09 10-5 mol de cystéine.
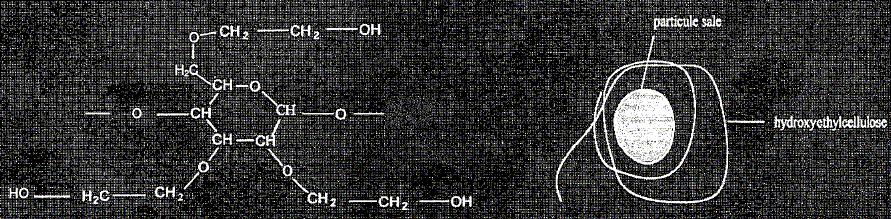
L'hydroxyéthylcellulose est soluble dans l'eau et est utilisée pour épaissir les shampoings. Elle rend le savon moins moussant et aide celui-ci à mieux laver les cheveux en formant des colloïdes autour des molécules de salissure. Normalement, les particules de salissure sont insolubles dans l'eau mais la chaine d'hydroxyéthylcellulose s'enroule autour de la salissure ; elle permet à celle-ci de rester dans l'eau et d'être évacuée par l'eau de rinçage.
Quels sont les deux groupes caractéristiques que vous reconnaissez dans ce motif ? -CH2-OH : alcool primaire >CH-O-CH< : groupe éther. Un savon classique peut être obtenu par saponification par une solution de soude ( hydroxyde de sodium) d'un triglycéride de formule :
Ecrire l'équation de la réaction correspondante puis nommer les produits.
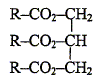
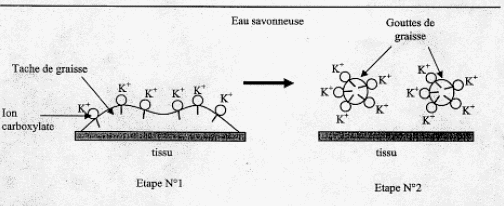
Hydrophile ( ami de l'eau) : groupe polaire -CO2-. Hydrophobe ( ennemi de l'eau ) : longue chaine carbonée R-. Expliquer succintement en quoi le mode d'action de l'hydroxyéthylcellulose est différent de celui d'un savon classique. La partie hydrophobe ( lipophile) du savon se fixe sur la graisse ( salissure) ; la partie hydrophile du savon entraîne la graisse dans l'eau. Il se forme des micelles, agrégat de molécules possédant une tête polaire hydrophile dirigée vers l'eau et une chaîne hydrophobe dirigée vers la graisse.
Appareils à lampes UV et produits filtrant. Dans un institut, on utilise un appareil à lampes UV pour "catalyser les ongles en gel". Cet appareil porte les indications suivantes : voltage 230 V, 6 tubes de 9 W. Calculer la puissance électrique totale consommée par les tubes. 6*9 = 54 W. Calculer l'intensité du courant électrique qui circule dans la ligne sur laquelle est branchée cet appareil. On considère que chaque tube se comporte comme un conducteur ohmique.
Le disjoncteur différentiel d'une vieille installation électrique porte les indications suivantes : 500 mA. Que représente cette indication et quel est le rôle du disjoncteur différentiel ? La présence d'un disjoncteur réduit le danger en ouvrant le circuit lorsque le courant dépasse une valeur donnée ( ici 500 mA) pendant un temps déterminé (en cas de court-circuit ou de surcharge). Lors d'un défaut sur l'installation, on constate un courant de fuite de 35 mA. Quel est le risque encouru par la clientèle ou les esthéticiennes ?
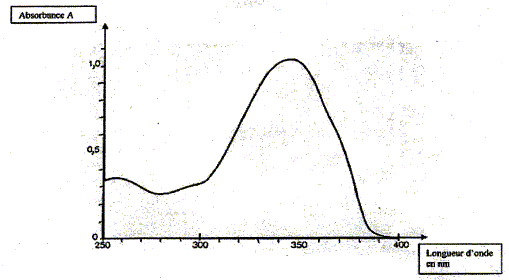
Disjoncteur différentiel à 30 mA. Analyse d'un produit filtrant. Le (4-isopropyl)dibenzolméthane ou Eusolex 8020 est un filtrant liposoluble de certains UV. Sa masse molaire moléculaire est M = 266 g/mol. Son spectre d'absorption A = f(l) est donné :
Il a été tracé à partir d'une solution contenant 1,0 mg de produit pour 100 mL de solution ; l'absorbance est mesurée pour une solution traversée d'épaisseur l= 1,0 cm. En utilisant ce spectre d'absorption, placer les différents domaines des UV sur un axe en fonction de leur longueur d'onde.
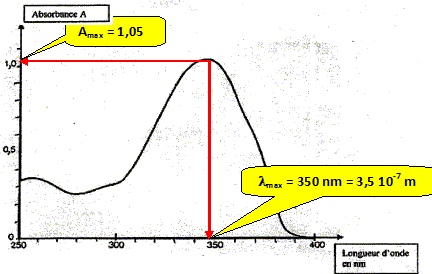
La relation fondamentale utilisée en spectrophotométrie est présentée sous la forme : A= log (I0/I) = elc ( A est l'absorbance ou densité optique) Cette loi est vérifiée lorsque la solution est de concentration inférieure à : c < 0,1 mol.L-1. e (L mol-1 cm-1) est une caractéristique de la molécule. Plus e sera grand, plus la solution absorbe. l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L). Relever sur la courbe la longueur d'onde lmax pour laquelle l'absorbance est maximale ainsi que la valeur de l'absorbance correspondante. En déduire le coefficient d'extinction molaire.
n(mol) = m(g) / m ( g/mol) = 10-3 / 266 = 3,76 10-6 mol ; C = n/V = 3,76 10-6 / 0,1 = 3,76 10-5 mol /L.
Calculer l'énergie d'un photon de longueur d'onde lmax en joule puis en électron-volt. h = 6,62 10-34 J s ; c = 3 108 m/s ; 1 eV = 1,6 10-19 J.
Par rapport à un photon du domaine visible, l'énergie de ce photon est-elle supérieure ou inférieure ? Justifier. L'énergie d'un photon est d'autant plus grande que sa longueur d'onde dans le vide est plus petite. Les photons UV ayant des longueurs d'onde inférieures à celles des photons vivibles, seront donc plus énergétiques.
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|