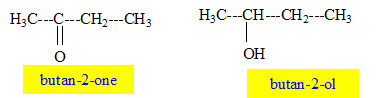|
L'acide lactique. Concours manipulateur électroradiologie médicale Caen 2008 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts |
|||||||
| .
. |
|||||||
|
|||||||
|
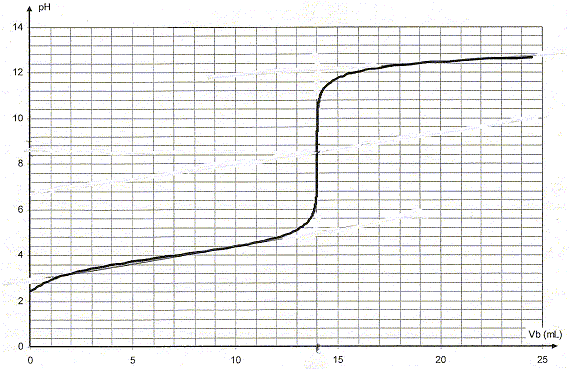
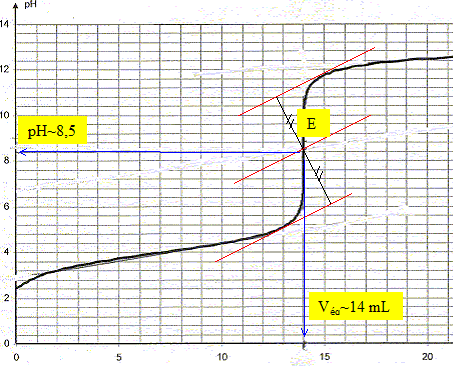
produit ionique de l'eau pKe = 14 ; couple acide/base : H3O+/H2O pKa1 = 0 ; H2O/HO- pKa2 = 14. Mon lait est-il frais ? Le sucre du lait, le lactose, se dégrade sous l'action de bactéries en acide lactique de formule semi-développée CH3-CH(OH)-COOH. La teneur du lait en acide lactique est donc un indicateur de sa fraîcheur. Dans cet exercice, on considérera pour simplifier que l'acide lactique est le seul acide présent dans le lait. Pour déterminer l'acidité du lait, on le dose par la soude puis on en deduit sa concentration en acide lactique. Cette concentration est exprimée en degré Dornic : 1 ° Dornic correspond à une concentration de 0,10 g d'acide lactique par litre de lait. Un lait frais ne doit pas dépasser 18° Dornic. Réaction de l'acide lactique avec l'eau. On dispose d'une solution de volume V = 100 mL d'acide lactique de concentration ca= 0,10 mol/L. Donner le nom systématique de l'acide lactique. acide 2-hydroxypropanoïque Quelle est la formule de l'ion lactate, base conjuguée de l'acide lactique ? On utilisera par la suite la notation AH / A-. CH3-CH(OH) - COO-. Le pH de la solution d'acide lactique est 2,5. Ecrire l'équation de la réaction entre l'acide lactique et l'eau. AH + H2O = A- + H3O+. Définir le taux d'avancement t puis le calculer. t = xfin/xmax avec xmax = caV et xfin = [H3O+] V = 10-pH V = 10-2,5 V. t =10-2,5/ca = 10-2,5 / 0,1 = 10-1,5 =3,2 10-2. La réaction entre l'acide lactique et l'eau est très limitée. Exprimer puis calculer la constante d'équilibre K correspondant à cette réaction. Cette valeur est-elle en accord avec la conclusion précédente ?
K=
[A-][H3O+]/[AH]. avec [A-]=
[H3O+] et
[AH]= ca-[A-]
=
ca-[H3O+]
=0,1-10-2,5=0,097 K = (10-2,5)2 /0,097
=1,0
10-4. K est très inférieur à 1,
la réaction entre l'acide lactique et l'eau
est donc limitée.
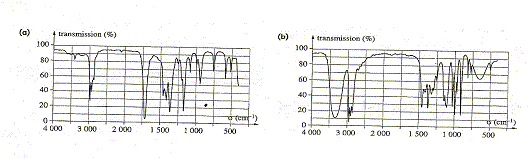
Identification d'une molécule. Données : c = 3,00 108 m/s ; 1 eV= 1,6 10-19 J ; h = 6,63 10-34 J s. Les groupements caractéristiques de la chimie organique absorbent des radiations électromagnétiques qui permettent d'identifier les molécules. Ces absorptions se présentent sous la forme de bandes d'absorption qui sont traditionnellement caractérisées par leur nombre d'onde moyen s = 1/l exprimé en cm-1. On obtient les courbes ci-dessous. Ce sont des spectres.
On donne quelques valeurs typiques : C=O : 1700 cm-1 ; O-H : 3350 cm-1 ; C=C : 1650 cm-1 ; C-C : 1100 cm-1. Calculer en micromètre, la longueur d'onde absorbée par le groupement C=O et celle absorbée par O-H. lC=O = 1/ s =1/ 1700 cm = 5,88 10-4 cm =5,88 10-6 m = 5,88 mm. lOH = 1/ s =1/ 3350 cm = 2,98 10-4 cm =2,98 10-6 m = 2,98 mm. Dans quelle zone du spectre des ondes électromagnétiques se situent la longueur d'onde absorbée par ces liaisons. Ces longueurs d'onde supérieures à 0,8 mm appartiennent au domaine infrarouge. Calculer en J puis en eV les énergies des radiations correspondantes. E= hc/l ; EC=O = 6,63 10-34 *3,00 108 / 5,88 10-6 =3,38 10-20 J. 3,38 10-20 /1,6 10-19 =0,211 eV. EO-H = 6,63 10-34 *3,00 108 / 2,98 10-6 =6,67 10-20 J. 6,67 10-20 /1,6 10-19 =0,417 eV.
L'existence de bandes d'absorption ( relativement étroites) impose une particularité à l'énergie d'une molécule. Quelle expression utilise t-on pour désigner cette particularité ? L'énergie d'une molécule est quantifiée. On considère deux molécules, la butan-2-one et le butan-2-ol. Donner la formule développée de ces molécules.
Attribuer à chacun des spectres ci-dessus, la molécule correspondante en justifiant. Le spectre "a" possède une bande d'absorption forte vers 1650 cm-1 caractéristique du groupe C=O ( butan-2-one) Le spectre "b" possède une bande d'absorption large vers 3350 cm-1 caractéristique du groupe OH associé par liaison hydrogène ( butan-2-ol) On s'aperçoit qu'il y a un pic commun à 2900 cm-1. De quelle liaison peut-il s'agir ? Justifier. Vibrations d’élongation de la liaison C–H.
|
|||||||
|
|
|||||||
|
|