|
Phénomène périodique ; zinc et acide chlorhydrique, gaz parfait lycée. En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Définir un phénomène périodique ; à quoi correspond la période ? la fréquence ? Le système étudié se retrouve dans un état identique au bout d'un certain temps appelé période, notée T, exprimée en seconde. La fréquence, exprimée en hertz (Hz) est le nombre de périodes par seconde.
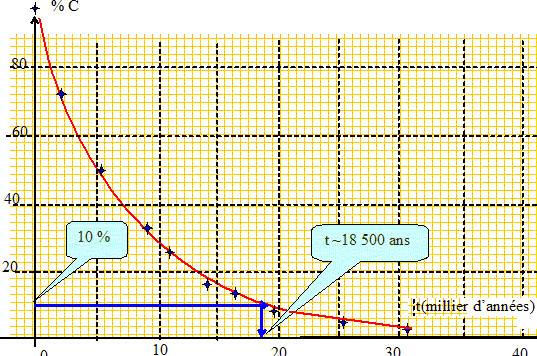
Le sablier permet de mesurer la durée de l'écoulement du sable. Ce n'est pas un phénomène périodique : l'écoulement étant terminé, plus rien ne se passe. Le phénomène n'est pas reproductible sans l'intervention d'une personne qui retournerait régulièrement le sablier. Pour mesurer des durées on peut faire appel aux propriétés du carbone 14 : il est possible de connaître l'âge de fragments d'os trouvés sur un site préhistorique Le pourcentage de carbone 14 fixé par les êtres vivants reste constant pendant la vie de l'organisme. Après sa mort ce pourcentage diminue. L'évolution du pourcentage en carbone 14 en fonction du temps t en années est toujours le même : l'origine des temps est prise à la mort de l'organisme.
Déterminer l'âge de fragments d'os sachant que leur teneur en carbone 14 n'est plus que de 10 %. Zinc et acide chlorhydrique. Lorsque l'on met en contact du zinc solide et de l'acide chlorhydrique, il se produit une transformation chimique et on observe un dégagement de dihydrogène gazeux. On recueille le dihydrogène par déplacement d'eau dans une éprouvette graduée de 250 mL. En utilisant une masse m=58,0.10-2g de zinc et en versant un volume Va=20,0 mL d'acide chlorhydrique de concentration c=1,00 mol.L-1 en ions H+(aq), le volume d'eau déplacé à l'état final est : Ve=205 mL à 20°C et sous une pression de 1,013.105 Pa." Expérimentalement comment expliquer que le gaz produit est bien du dihydrogène ? Enflammer une petite quantité de gaz : une petite détonnation est perçue. Proposer une équation chimique symbolisant la réaction chimique entre Zn(s) et H+(aq). Couples acide /base : Zn(s) / Zn2+ ( aq) ; H2(g) / H+(aq). Zn(s) + 2 H+(aq) = Zn2+ ( aq) + H2(g) Proposer un test permettant de caractériser la nature des ions produits. En présence d'hydroxyde de sodium, l'ion Zn2+ ( aq) donne un solide blanc, l'hydroxyde de zinc Zn(OH)2 (s). Ce dernier se dissout dans un excès d'hydroxyde de sodium.
Exprimer le volume Vg de gaz recueilli en fonction du volume Ve d'eau déplacé et Va d'acide versé. Calculer Vg. Le dihydrogène étantpratiquement insoluble dans l'eau, il déplace l'eau de l'éprouvette graduée. Le volumde de dihydrogène est égal au volume d'eau déplacé : Vg = Vg = 200 mL. Calculer la quantité de matière de dihydrogène recueillie. Le dihydrogène est considéré comme un gaz parfait. PV = nRT avec pression P = 1,013.105 Pa , température T = 273+20 = 293 K ; volume V = 205 mL = 0,205 L = 0,205 10-3 m3 et R = 8,3 S.I
Calculer la quantité de matière des réactifs présents à l'état initial. Masse molaire du zinc : M=65,4 g/mol Quantité de matière initiale de zinc :
Comparer la quantité de matière de dihydrogène calculée à l'état final à celle obtenue par la mesure de volume. =8,87 10-3 mol Si le zinc est en défaut : 8,87 10-3 -xmax =0 ; xmax =8,87 10-3 mol Si l'ion H+(aq) est en défaut : 20 10-3 -2xmax =0 ; xmax =10 10-3 mol Retenir la plus petite valeur xmax =8,87 10-3 mol. La quantité de matière de H2 théorique est : 8,87 10-3 mol , valeur un peu supérieure à la valeur expérimentale. L'écart relatif vaut environ : (8,87-8,54) / 8,7~
4 % ( 0,04)
A 20°C, sous une pression de 1,013 105 Pa, la solubilité du dihydrogène dans l'eau est égale à 1,60 mg.L-1, c'est-à-dire qu'une masse de 1,60 mg de dihydrogène peut se dissoudre dans 1 litre d'eau. En considérant que le dihydrogène s'est dissous dans le volume d'eau déplacé, évaluer la quantité de matière de dihydrogène dissous. M(H2) = 2 g/mol. masse dissoute dans 0,205 L d'eau : 1,60 *0,205/1 =0,328 mg = 0,328 10-3 g.
En déduire la quantité de matière totale de dihydrogène produit. 1,64 10-4 + 8,54 10-3 =8,69 10-3 mol. Cette valeur est-elle davantage en accord avec celle calculée lors du bilan de matière ? Oui. L'écart relatif vaut environ : (8,87-8,69) / 8,8~ 2 % ( 0,02)
Gaz parfait. Une chambre à air est gonflée avec de l'air sous une pression P= 5,0 105 Pa alors que la température extérieure vaut 20°C. Calculer la température absolue correspondante. T = 273+20 = 293 K. Dans quelles conditions habituelles de température et de température l'air peut-il être assimilé à un gaz parfait ? Il faut se situer loin des conditions de température et de pression correspondant à la liquéfaction de l'air. ( pression faible et température de l'ordre de 20°C ) Dans ces conditions on peut négliger les interactions entre molécules d'air et considérer l'air comme un gaz parfait. Quelle est l'équation des gaz parfaits. PV = nRT avec pression P ( Pa) , température T ( K) ; volume V ( m3 ) ; n : quantité de matière (mol) et R = 8,3 S.I, une constante. Si on avait gonflé la chambre à air avec du diazote, le volume de la chambre serait-il le même que celui de la chambre gonflé à l'air dans les mêmes conditions de température et de pression. = constante *
n. Si la quantité de matière d'air est différente de la quantité de matière de diazote, alors le volume est différent. La chambre à air est exposée au soleil : la température atteint 45 °C. Calculer la pression de l'air dans la chambre ( la chambre à air étant prisonnière dans un pneu, son volume est resté constant). = constante *
T. T2 = 273+45 =318 K
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||