|
Soluble,
miscible, extraction par solvants,
chromatographie En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||||||||||||||||
| .
. |
||||||||||||||||
|
||||||||||||||||
- La solubilité de l'acide benzoïque dans l'eau est de 2,4 g /L à 20 °c signifie : On peut dissoudre au maximum 2,4 g de solide dans 1 L d'eau à 20 °C. - Si l'on verse 3 g d'acide benzoïque dans 500 mL d'eau, à 20 °C, on observe alors : 1,2 g de solide se dissout dans l'eau ; 1,8 g de solide ne peut pas se dissoudre et tombe au fond du récipient. La solution est qualifiée de saturée. Miscible : - L'eau et l'éthanol sont miscibles ; l'eau et l'éther ne sont pas miscibles : En mélangeant de l'eau et de l'alcool, on observe un liquide homogène ; en mélangeant de l'eau et de l'éther, on observe un liquide hétérogène : deux couches liquides se superposent, le liquide le plus dense occupant la partie inférieure. Extraction par solvants : - L'espèce à extraire doit être très soluble dans l'un des solvants, et peu soluble dans l'autre. - Les deux solvants ne doivent pas être miscibles. Pour extraire l'acide benzoïque d'une solution aqueuse, l'éther est un solvant qui convient. Le protocole est le suivant : Prélever 100 mL de soda dans un
erlenmeyer. Ajouter goutte à goutte une solution de
carbonate de sodium jusqu' à ce que le pH
atteigne la valeur 9. Verser le prélèvement dans un
bécher de 250 mL, ajouter 100 mL de
dichlorométhane et agiter sous hotte
aspirante sur agitateur
magnétique. L'ion carbonate CO32- est une base : elle neutralise les acides contenus dans le soda, dont le pH initial est proche de 3. Rôle de l'agitation du mélange eau-dichlorméthane. On oblige les deux solvants à se mélanger : la plus grande partie de la caféine, plus soluble dans le dichlorméthane que dans l'eau, passe dans le dichlorométhane. Pourquoi travaille-t-on sous hotte aspirante ? Le dichlorométhane est nocif : il ne faut pas
respirer les vapeurs ; il faut éviter le contact avec
la peau et les yeux.
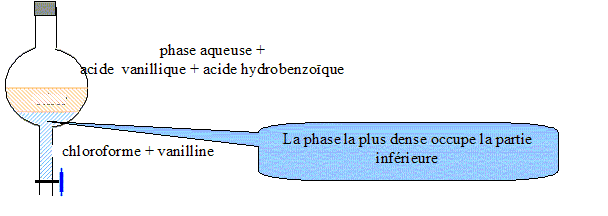
L'arôme de vanille commercial contient trois espèces chimiques : la vanilline, l'acide vanillique et l'acide hydrobenzoïque. L'arôme de vanille n'est pas une espèce chimique : c'est un mélange de trois espèces chimiques. Protocole expérimental : Diluer de l'extrait de vanille dans l'eau puis verser dans une ampoule à décanter. Ajouter du chloroforme dans l'ampoule, agiter vigoureusement, et laisser décanter. Données : Le chloroforme est plus dense que l'eau ; la vanilline est très soluble dans le chloroforme mais peu soluble dans l'eau ; l'acide vanillique et l'acide hydrobenzoïque sont très solubles dans l'eau. Le schéma annoté de l'ampoule à décanter après agitation et décantation :
Le chloroforme, le solvant d'extraction, permet d’extraire la vanilline de l’arôme de vanille. Quelles opérations faut-il effectuer pour isoler la vanilline pure ? Sécher de la phase organique à l'aide de sulfate de sodium anhydre. Filtrer pour éliminer le sulfate de sodium hydraté. Distiller le solvant, le chloroforme.
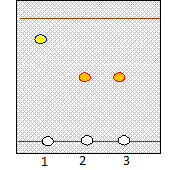
Chromatographie. On réalise la chromatographie d'un lait afin de connaître sa composition en glucides. On a obtenu le chromatogramme suivant :
R = 2 / 4,5 =0,44 ; R1 = 1 / 4,5 =0,22. Comparer le chromatogramme du mélange lactose + glucose aux deux autres. Conclure. Dans le chromatogramme du mélange lactose + glucose on identifie deux espèces : le glucose et le lactose. A partir du chromatogramme du lait, déduire quel est le principal glucide qui y est contenu. Dans le chromatogramme du lait on identifie le lactose. Donner le protocole opératoire nécessaire ( différentes étapes de manipulation) pour effectuer une CCM. Quel est l'objectif de la chromatographie sur couche mince ? La chromatographie permet de séparer et d'identifier les constituants d'un mélange en utilisant la différence de solubilité d'un produit entre une phase fixe et une phase mobile, l'éluant. La révélation est nécessaire, chaque fois que les produits ou réactifs sont incolores. Indiquer le matériel nécessaire à la réalisation d'une CCM. Bécher, couvercle, solvant ( éluant), plaque CCM, produit à analyser, substances étalons ( référence). Décrire sommairement le principe de la chromatographie sur couche mince. Tracer au crayon à papier une ligne à un peu plus de 1 cm du bas de la plaque . Marquer au crayon sur cette ligne les emplacements où l'on déposera les solutions à analyser. Les emplacements doivent être distants d'environ 1 cm, et à au moins 1 cm des bords. Dépôt de l'échantillon : A l'aide d'unepipette pasteur, ou d'un tube capillaire, déposer une goutte sur la plaque à l'emplacement marqué. Laisser sécher . Si la solution est trop diluée, on peut faire plusieurs dépôts au même emplacement , à condition de bien sécher la plaque entre deux gouttes. Développement du chromatogramme : Lorsque les dépôts sont secs, placer la plaque le plus verticalement possible dans la cuve, ligne de dépôt vers le bas. La surface de l'éluant doit être en de cette ligne. Couvrir. Surveiller la plaque régulièrement : quand l'éluant est à environ 1 cm du bord supérieur, sortir la plaque, marquer le niveau atteint par le solvant au crayon à papier, sécher la plaque. Révélation : Si les taches sont incolores, on les fera apparaître sous une lampe UV ou à l'aide d'un chimique. Par exemple les fonctions alcool des sucres réduisent le permangante de potassium qui vire au jaune.
La benzocaïne est préparée industriellement à partir de benzoate d'éthyle. La benzocaïne est soumise aux deux analyses suivantes : Mesure du point de fusion : le produit de la synthèse est un solide blanc qui fond à 92° C sous une pression de 1 bar. Donnée : la benzocaïne pure dond à 92°C sous une pression de 1 bar. Chromatographie sur couche mince : La phase fixe est une plaque de verre recouverte de silice. L'éluant est l'acétate d'éthyle. On effectue trois dépôts. Après révélation sous lampe UV, on obtient le chromatogramme suivant : Dépôt 2 :
benzocaïne pur Dépôt 3 :
benzocaïne
synthétisée. La phase fixe est la plaque de verre recouverte de silice. La phase mobile est l'acétate d'éthyle. Conclusion de l'analyse chromatographique : Les tâches 2 et 3 ont migrées à la même hauteur : il s'agit donc de la même espèce chimique ( benzocaïne). Le produit de synthèse ne contient pas de benzoate d'éthyle. Conclusion de la mesure du point de fusion : La benzocaïne synthétisée et la benzocaïne pure ont le même point de fusion : il s'agit de la même espèce chimique, ce que confirme l'analyse chromatographique.
|
||||||||||||||||
|
|
||||||||||||||||
|
|