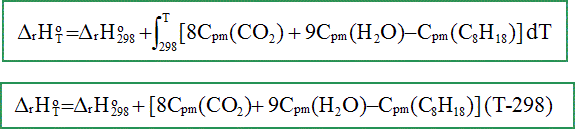|
Combustion isobare du mélange air essence ; thermochimie de la silice concours mines 06 En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Le mélange gazeux est constitué de n = 4.10-2 mol d’air et de n’ = 2.10-4 mol d’essence et se trouve alors dans les conditions : VB = 0,125 L ; TB = 673 K ; PB = 18,4 bar Le gaz subit alors la transformation : B --> C : une étincelle provoque la combustion isobare, instantanée, de toute l’essence ; cette évolution est également adiabatique pour l’ensemble du système réactif. Remarque : la combustion étant en réalité isochore et non isobare, on ne s’étonnera pas de trouver une température TC sensiblement différente de celle proposée dans le problème de physique. Données : R=8,314 J
K-1 mol-1. A 298 K : Le carburant utilisé est de l’octane C8H18. Ecrire et équilibrer la réaction de combustion d’une mole d’octane avec le dioxygène de l’air pour former CO2(g) et H2O(g). C8H18(g) + 12,5O2(g) = 8 CO2(g) + 9 H2O(g) Calculer l’enthalpie standard de cette réaction à 298K. DrH° = 9 DfH° (H2O) + 8 DfH°(CO2)- DfH°(C8H18) DrH°298 = 9*(-242)+8*(-394)-580 = -5,91 103 kJ /mol. Exprimer puis calculer l’enthalpie standard de cette réaction à TB.
DrH°673
= -5,91 106 +1,74
105 DrH°673
= -5,736 106 J/mol =
-5,736 MJ
mol-1. Justifier que l’énergie thermique dégagée par la combustion de l’octane sert à échauffer les gaz de combustion de TB à TC . La transformation est adiabatique : pas d'échange d'énergie avec le milieu extérieur. L'énergie dégagée par la combustion sert à élever la température des produits et du diazote. Faire un bilan molaire des espèces présentes en début puis en fin de combustion. Initial : n = 4.10-2 mol d’air et de n’ = 2.10-4 mol d’essence n(O2)= 4.10-2*0,2 =8 10-3 mol ; n(N2)= 4.10-2*0,8 =3,2 10-2 mol.
si C8H18 est en défaut : 2 10-4 -5xfin =0 ; xfin = 2 10-4 mol. Retenir la plus petite valeur xfin = 2 10-4 mol. Justifier la phrase : « Dans toute l’étude de ce modèle de moteur à explosion, on suppose constant le nombre total de moles gazeuses ». Initial : n+n' = 4.10-2 + 2.10-4 = 4,02 10-2 mol. Final : 5,5 10-3 +1,6 10-3 +1,8 10-3 +3,2 10-2 = 4,09 10-2 mol. Le nombre total de mol est pratiquement le même.
Les tables thermodynamiques donnent les enthalpies standard de formation suivantes (à 298K) :
Pourquoi les enthalpies de formation du silicium et du dioxygène sont nulles ? Il s'agit de corps purs simples pris dans leur état standard à 298 K. Leur enthalpie de formation est nulle, par définition. La liaison Si – O présente une énergie de liaison ESi-O= 796 kJ mol-1. L’énergie de la liaison O = O vaut EO=O= 498 kJ mol-1. On rappelle que l’énergie de liaison est l’énergie à fournir pour casser une mole de liaison, les constituants étant tous à l’état gazeux. On donne l’enthalpie de sublimation du silicium : DsubH° (Si) =399 kJmol-1. Etablir un cycle thermodynamique et donner alors l’expression littérale et la valeur numérique de l’enthalpie de sublimation de la silice.
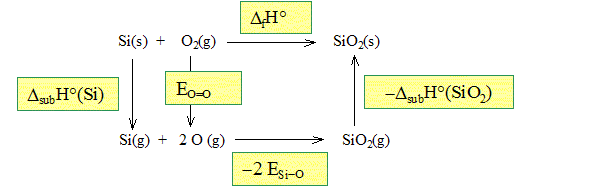
DfH°=DsubH° (Si) + EO=O -2ESi-O -DsubH° (SiO2). DsubH° (SiO2)=DsubH° (Si) + EO=O -2ESi-O -DfH°. DsubH° (SiO2)= 399 + 498-2*796-(-911) DsubH° (SiO2)= 216 kJ/mol.
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|