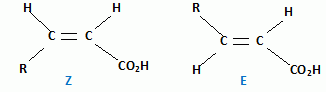|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||
| .
. |
||||||||
|
||||||||
|
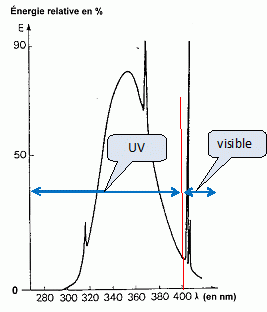
Installation d'un solarium. Le circuit électrique prévu pour brancher le solarium est protégé par un disjoncteur thermique portant l'indication 16 A. Il est alimenté sous une tension électrique de 230 V. La puissance électrique du solarium est P =3240 W. Justifier, en calculant l'intensité , que l'appareil choisi est adapté à l'installation. On admet que le solarium se comporte comme une résistance pure en régime permanent. Intensité ( A) = puissance (W) / tension (V) I = 3240/230 =14,0 A. Cette intensité étant inférieure à la valeur maximale admissible ( 16 A), le solarium est adapté à l'installation électrique. Sur la même prise du secteur, en dérivation sur le solarium, on voudrait alimenté un appareil de chauffage- climatisation réversible, mobile, d'une puissance de 1000 W. En déduire que le disjoncteur déclencherait lors de la mise sous tension. Puissance totale des appareils branchés à la sortie du disjonteur thermique : 3240 + 1000 = 4240 W Nouvelle intensité en ligne : 4240/230 = 18,4~ 18 A. Cette valeur est supérieure à l'intensité maximale admissible : le disjonsteur thermique se déclenche à la mise sous tension. On s'intéresse à l'un des tubes d'émission UV du solarium dont on donne le spectre d'émission. Repérer, sur un axe gradué en longueur d'onde, les différents domaines de lumières émises par le tube.
Irradiance totale : 27,0 + 0,38 = 27,38 W m-2 ; Le rayonnement laser se révèle dangereux pour les yeux : son intensité est comparable à plusieurs fois celle d'un rayon solaire. l'intensité de la lumière émise par les tubes du solarium n'ont rien à voir avec l'intensité de la lumière laser. eci le rend très dangereux pour les yeux Etude de quelques actions chimiques du rayonnement UV sur la peau. La couche cornée contient de l'acide urocanique, véhiculé par la sueur, qui absorbe les UVB. On donne la formule de cet acide : 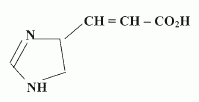 On pourra l'écrire plus simplement R-CH=CH-CO2H. Le rayonnement UV peut déclencher une isomérisation Z / E.
Ecrire
les formes Z et E de l'acide urocanique. La formation
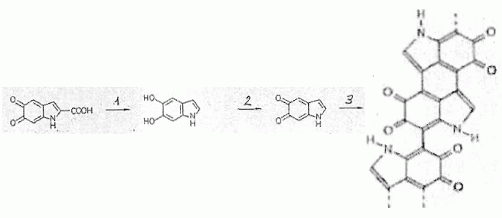
de la mélanine se fait par une succession de réactions chimiques
débutant avec la phénylalanine. Parmi l'ensemble de ces réactions
chimiques, on donne le schéma suivant : On passe d'un monomère à un polymère : réaction
de polymérisation ( addition ou condensation de monomères) Ecrire
la demi équation électronique correspond à l'étape 2 et préciser
sa nature.
Ecrire la demi-équation électronique de cette réduction. MnO4- aq + 8 H+aq + 5e- = Mn2+ aq + 4H2O(l). Ecrire l'équation associée à la réaction corresdpondant à l'étape 2 lors de l'action des ions permanganate. 2 MnO4- aq + 16 H+aq + 10e- = 2Mn2+ aq + 8H2O(l). 5 fois { 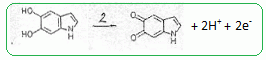 } }Puis additionner et simplifier. 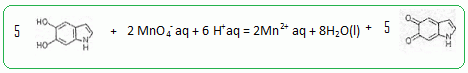
Dosage acide base. On réalise un dosage acido-basique, suivi par pHmétrie, d'une solution aqueuse d'acide urocanique, noté R-COOH. On prépare une solution d'acide urocanique en dissolvant une masse m g de l'acide dans 1,000 L d'eau à la température ambiante. On dose ensuite V = 200 mL de cette solution avec une solution d'hydroxyde de sodium de concentration molaire C = 0,010 mol/L. Le graphe suivant donne la variation du pH au cours du dosage. Ecrire l'équation associée à la réaction support du dosage. R-COOH aq + HO-aq = R-COO-aq + H2O(l) Définir l'équivalence et déterminer graphiquement le point d'équivalence. A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques ; avant l'équivalence, l'un des réactifs est en excès, après l'équivalence, l'autre réactif est en excès. 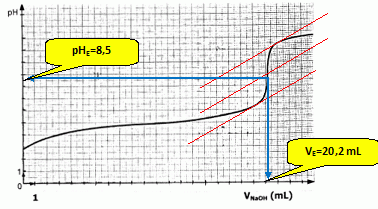
|
||||||||
| |
||||||||
|
|