|
Distillation,
diagramme binaire eau éthanol
concours chimie Capes
2007.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||
| .
. |
||||||||||||||||||||
|
||||||||||||||||||||
|
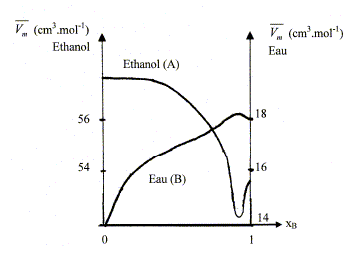
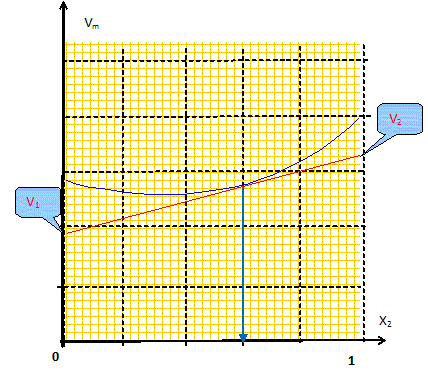
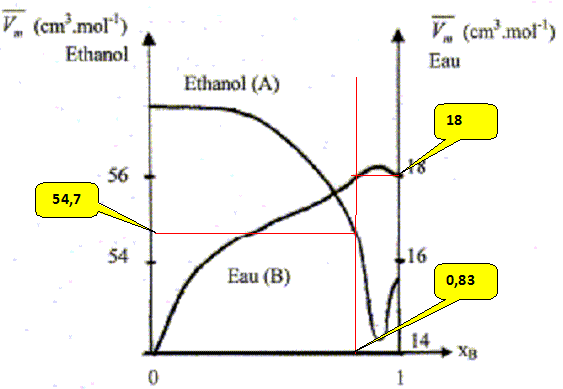
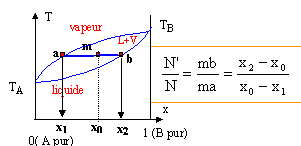
mélange idéal : microscopiquement la solution se comporte comme un liquide pur : les interactions entre molécules différentes et molécules identiques sont égales. Il faut pour cela que les molécules soient assez semblables ( exemple O2 et N2). L'eau et l'éthanol ne constituent pas un mélange idéal. Le volume total d’une solution binaire idéale vaut : V = n1Vm,1 + n2Vm,2. Vm i : volume molaire d'un constituant pur ; ni : quantité de matière (mol) Ou en divisant par n1+n2 : Vm = x1Vm,1 + x2Vm,2= Vm,1 +x2(Vm,1 -Vm,2) (1) Vm : volume molaire de la solution ; xi : fraction molaire x1+x2 = 1. Les forces intermoléculaires entre les différentes espèces conduisent à des volumes réels inférieurs ou supérieurs à celui prévu. Les volumes molaires partiels des espèces sont différents des volumes molaires de ces mêmes espèces à l'état pur. (1) s'écrit : Vm =V1 +x2(V1 -V2) (2) V i : volume molaire partiel d'un constituant.
Les volumes molaires partiels à pour une composition donnée sont obtenus par les interceptions de la tangente à la courbe Vm = f(x2) avec les axes verticaux x2 = 0 et x2 = 1. masse volumique de l'éthanol A
: rA = 785 km
m-3 = 0,785 g/mL masse volumique de l'eau B :
rB = 1000 km m-3 =
1,00 g/mL Masses molaire ( g/mol) : eau : 18 ;
éthanol : 46. Calcul du volume du
mélange obtenu :
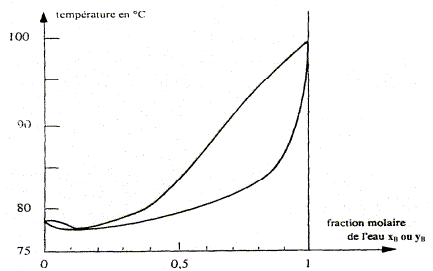
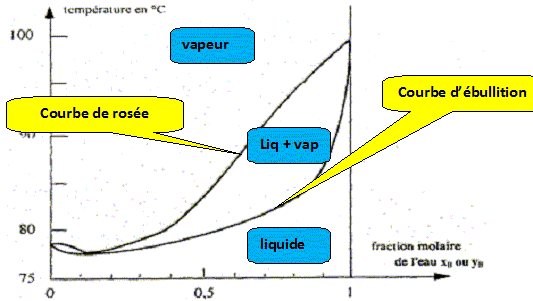
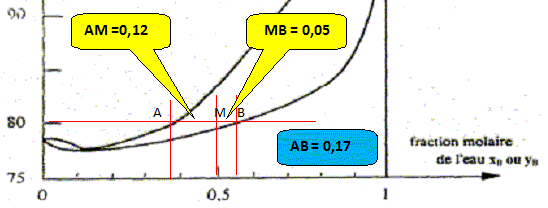
Nom du point de coordonnées xB=0,11 et T= 78,3°. azéotrope. courbe de rosée, ensemble des points où apparaît la première goutte de liquide lorsqu'on refroidit de la vapeur. courbe de d'ébullition, ensemble des points où apparaît la première goutte de vapeur lorsqu'on chauffe le liquide.
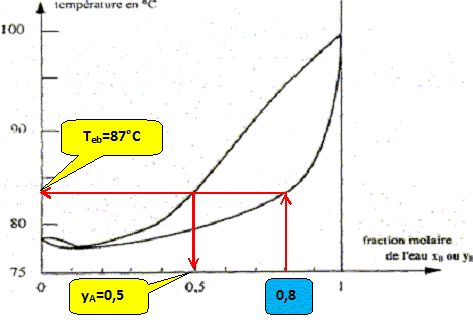
On considère une mole de mélange liquide de fraction molaire xB=0,8, initialement à 20 °C que l'on chauffe sous pression constante P= 1,013 bar. A quelle température Teb ( °C) l'ébullition commence t-elle et quelle est la fraction molaire en alcool yA de la première bulle formée ?
A quelle température Tev ( °C) la dernière de liquide s'évapore t-elle et quelle est la fraction molaire en alcool xA de cette dernière goutte ? La vapeur s'enrichi en alcool, constituant le plus volatil. Le liquide s'appauvrit en alcool : xB tend vers 1, eau pure, s'évaporant à 100°C.
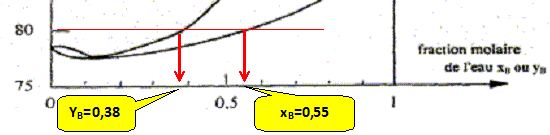
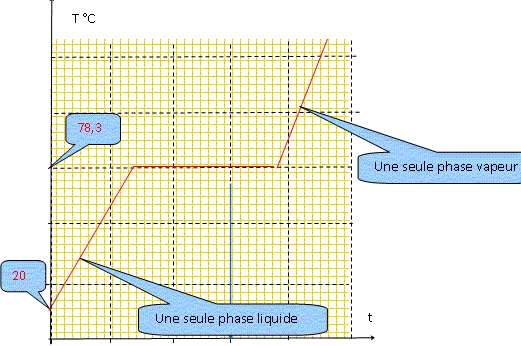
Conséquences pratiques de l'existence de l'azéotrope : - séparation de l'eau et de l'éthanol impossible à réaliser dans une installation de distillation à une colonne : le distillat à la composition de l'azéotrope. La composition de l'azéotrope varie avec la pression. On chauffe progressivement un mélange eau/éthanol de fraction molaire xB=0,11 initialement à 20 °C, en enregistrant la température. Représenter qualitativement la courbe donnant l'évolution de la température en fonction du temps, en faisant apparaître les domaines monophasés et biphasés.
A l'azéotrope la phase liquide et la phase vapeur ont la même composition : deux constituants et une relation. Présence de deux phases d'où la variance v = (2-1)+2-2 = 1. La pression étant
fixée, le système est invariant. La
température d'ébullition, à
l'azéotrope, est constante.
|
||||||||||||||||||||
|
|
||||||||||||||||||||
|
|