|
Enthalpie
; sens d'évolution d'un système :
synthèses HF et H2
concours ingénieur
Minefe 2008.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(1) CaF2(s) + H2SO4(l) = CaSO4(s) + 2HF(g). On donne les enthalpies standards de formation DrH° et les entropies molaires standards Sm° à 25 °C :
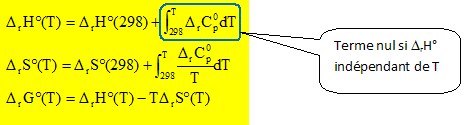
Définir et calculer la variance d'un système où se produit l'équilibre (1). La règle des phases donne la variance d'un système thermodynamique : v = c+2-j Le chiffre 2 indique le nombre de paramètres intensifs. c : nombre de constituants indépendants ( nombre de constituants - nombre de réactions chimiques indépendantes entre ces constituants) Nombre de constituants : c=4 ; nombre de relation : 1 ; nombre de phase : j= 4 v = c-1+2-j= 4-1+2-4 =1. On peut faire varier la température ou la pression. Calculer l'enthalpie libre standard de cette réaction à 298 K ? Pour une mole de HF formé :(1) ½CaF2(s) + ½ H2SO4(l) = ½ CaSO4(s) + HF(g). DrH° =½DrH°(CaSO4(s)) + DrH°(HF) -½DrH°(H2SO4(l))-½DrH°(CaF2(s)) DrH° = -½*1434,1-271,1 +½ *814 + ½ *1219,6 ; DrH° = 28,65 kJ mol-1. DrS° =½S°(CaSO4(s)) + S°(HF) -½S°(H2SO4(l))-½S°(CaF2(s)) DrS° =½*106,7+173,7-½*156,9-½*68,9 = 114,15 J mol-1 K-1 DrG° =DrH° - TDrS° =28,65 - 298*0,11415 = -5,37 kJ mol-1 pour 1 mole de HF formé. La constante d'équilibre s'écrit :
K = PHF. De plus DrG°
=-RT
ln K ; ln K = -5,37 103/(-8,31*298)
=2,17 K = 8,7 d'où
PHF =
8,7 bar. A t-on
intérêt à pratiquer cette
synthèse à faible pression ou
à haute pression ? Si la pression augmente, le nombre de
molécules de HF croît : en
conséquence l'équilibre est
déplacé vers la gauche, sens
indirect, diminution du nombre de molécules
HF. On a donc intérêt à
travailler à faible pression.
Dans un nouvel état initial, le système ne contient que 10 moles de méthane et 10 moles d'eau. Déterminer la composition du système à l'équilibre. Ptot = 10 bar. Fractions molaires :
Composition du système à l'équilibre :
DrH° = 206 kJ / mol. : la réaction est endothermique. Une élévation isobare de température déplace l'équilibre dans le sens direct. Au système à l'équilibre on ajoute de façon isotherme et isobare, une mole de monoxyde de carbone. Dans quel sens se produira l'évolution ? Le système évolue dans le sens de la consommation de monoyde de carbone : sens indirect.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|