|
acide base ; oxydoréduction ( concours manipulateur radio AP HP 2009)
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
|
Exercice 1 : On dissout du chlorure d'hydrogène dans l'eau pure. Quels sont les ions présents en solution ? oxonium H3O+aq et chlorure Cl-aq. Donner la relation de définition du pH. pH = - log [H3O+aq ] avec [H3O+aq ] exprimée en mol/L. On dissout 48 L de chlorure d'hydrogène dans 1 m3 d'eau. Si l'on considère la réaction entre le chlorure d'hydrogène et l'eau comme totale, quel est le pH de la solution obtenue ? Vm = 24 L/mol. Quantité de matière de HCl(g) = n = V/Vm = 48/24 = 2,0 mol. HCl(g) +H2O(l)=H3O+aq +Cl-aq. n(H3O+aq ) = n = 2,0 mol [H3O+aq ] = n / volume de la solution en litre = 2,0 / 1000 =2,0 10-3 mol/L. pH = - log [H3O+aq ] = - log(2,0 10-3) =3 - log 2 = 3-0,3 = 2,7.
La couleur bleue initiale est due aux ions Cu2+aq ; le dépôt rouge est du cuivre métallique. Réduction des ions cuivre (II) en cuivre métallique : Cu2+aq + 2e- = Cu(s). Le zinc, métal plus réducteur que le cuivre, s'oxyde : Zn(s) = Zn2+aq + 2e-. Cu2+aq + Zn(s) = Cu(s) + Zn2+aq. Quel est le type de transformation observée ? Les quantités de matière des réactis sont modifiées : donc transformation chimique. La masse de cuivre déposée est m = 127 mg. le volume de la solution est égal à 100 mL. m(Cu) = 63,5 g/mol) Quelle était la concentration initiale des ions Cu2+aq ? n(Cu) finale = m / M = 127 / 63,5 = 2,00 mmol. n(Cu2+aq) initiale = n(Cu) finale = 2,00 mmol. [Cu2+aq] = n(Cu2+aq) initiale /V = 2,00 / 100 = 2,00 10-2 mol/L.
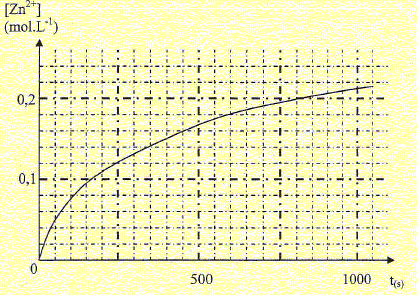
Exercice 3 : L'acide chlorhydrique réagit sur Ie zinc suivant l'équation de réaction supposée totale : 2H30+aq + Zn (s)= H2 (g)+Zn2+aq+2H2O(l) A l'instant t = 0 s, on introduit une masse m = 1,0 g de zinc en poudre dans un ballon contenant v = 40 mL d'une solution d'acide chlorhydrique de concentration molaire CA = 0,50 mol/L. On mesure Ie volume V de dihydrogène formé au cours du temps. L'avancement x de la réaction à une date t est égal àla quantité de matière d'ions Zn2+aq formés à cette date. JustifIer"(on pourra s'aider d'un tableau d'avancement).
Si le zinc est en défaut 1,5 10-2-xmax = 0 ; xmax =1,5 10-2 mol
dihydrogène atteint V = 0,125 L. n(H2) = x = V / Vm =0,125/25 = 5,0 10-3 mol. [Zn2+aq] = x/v = 5,0 10-3 / 40 10-3 = 5/40 = 0,125 mol/L ~0,13 mol/L.
|
|||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||
|
|