|
Solution tampon. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
|
Quels sont les volumes respectifs des solutions d'acide phosphorique, de soude et d'eau distillée à mélanger pour réaliser le tampon ? On rappelle les pKa successifs de l'acide phosphorique (2,2 ; 7,2 ; 12,3 ). Couples acide / base : pK1 (H3PO4 / H2PO4-) = 2,2 ; pK2 (H2PO4- / HPO42-) = 7,2 ; pK3 (HPO42- / PO43- ) = 12,3 ; 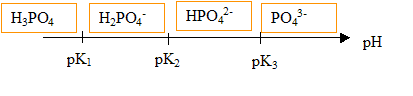 Hypothèse : à pH 6,5, les espèces H2PO4- et HPO42- sont majoritaires ; le couple (H2PO4- / HPO42-) fixe le pH. pH = pKa2 + log ([HPO42-] / [H2PO4-]) ; log ([HPO42-] / [H2PO4-]) = 6,5-7,2 = -0,7. [HPO42-] / [H2PO4-] =0,20 ; [HPO42-]= 0,20 [H2PO4-] De plus : [HPO42-] + [H2PO4-] ~0,4 mol/L. On a donc introduit 0,4 *0,2 = 0,08 mol d'acide phosphorique, soit un volume égal à : 0,08/1,6 = 0,050 ( 50 mL). [HPO42-] +0,20 [H2PO4-] = 0,4 ; [H2PO4-] = 0,4/1,2 = 0,333 mol/L soit 0,333*0,2 = 0,0666 mol dans 200 mL [HPO42-] =0,2*0,333 =0,0667 mol/L soit 0,0667*0,2 = 0,0133 mol dans 200 mL Dosage de la première acidité de l'acide phosphorique :
Quantité de matière totale de soude : 0,0133+0,08 =0,0933 mol, soit en volume : 0,0933/1 = 0,0933 L ( 93,3 mL). Eau distillée : 200-50-93,3 =56,7 mL.
|
||||||||||||||||||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||||||||||||||||
|
|