|
|
||||||||||||||||||||
|
||||||||||||||||||||
|
L'hydroxyde d'aluminium est pratiquement insoluble ; pKs = 33. Cet hydroxyde est introduit dans l'eau pure.
corrigé |
||||||||||||||||||||
|
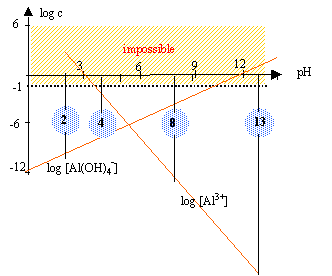
Ks = [Al3+] [HO-]3 = 10-33. d'après les coefficients de l'équation ci-dessus : [HO-] = 3 [Al3+] repport dans l'expression du produit de solubilité : [HO-]4 = 3 10-33 [HO-] = 7,4 10-9 mol/L d'où s = [Al3+] = 2,47 10-9 mol/L [H3O+] = 10-14 / 7,4 10-9 = 1,3 10-6 mol/L et pH =5,9. autoprotolyse de l'eau : Les valeurs précédentes sont fausses lorsque 5,9 < pH < 8 il faut tenir compte des ions HO- et H3O+ issus de l'autoprotolyse de l'eau. l'autoprotolyse de l'eau est dans ce cas la réaction prépondérante 2H2O en équilibre avec HO- + H3O+ avec Ke = 10-14 à 25°C et [H3O+] = [HO-] [H3O+] [HO-] = [H3O+]² = 10-14 soit pH=7. d'où s = [Al3+] =Ks /[HO-] 3= 10-33 / (10-7)3 = 10-12 mol/L. équilibre de précipitation : Al(OH)3 en équilibre avec Al3+ + 3HO-. Ks = [Al3+] [HO-]3 = 10-33 = [Al3+] (10-14)3 / [H3O+]3. log [Al3+] -42 -3 log [H3O+] = -33 log [Al3+] +3pH = 9 soit log [Al3+] =9-3pH. équilibre de complexation : [ Al(OH)4]-en équilibre avec Al3+ + 4HO-. Kd= [Al3+] [HO-]4 / [ Al(OH)4]-] = 10-35 = [Al3+] (10-14)4 / ( [H3O+]4[ Al(OH)4]-] ) log [Al3+] -56 -4 log [H3O+] -log[ Al(OH)4]-] = -35 log [Al3+] +4pH -log[ Al(OH)4]-] = 21 tenir compte de : log [Al3+] =9-3pH. d'où 9+pH-log[ Al(OH)4]-] =21 log[ Al(OH)4]-] = -12 + pH.
s = [Al3+] + [ Al(OH)4]-] s = 10 9-3pH + 10 -12+pH dériver par rapport à pH : ds/dpH = -3 10 9-3pH + 10 -12+pH dériver encore une fois : d²s / dpH² = 910 9-3pH + 10 -12+pH toujours positive donc la solubilité passe alors par un minimum lorsque la dérivée première s'annule rechercher la valeur du pH qui annule cette dérivée. -3 10 9-3pH + 10 -12+pH=0 3 10 9-3pH =10 -12+pH prendre le logarithme de chaque membre log 3 +9-3pH = -12 +pH 0,477 +21 = 4pH pH = 5,37.
retour - menu |