Combustion de fer, pile électrochimique, synthèse, acide chlorhydrique.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
Combustion du fer.
La
poudre de fer brûle dans l'air.
Cette transformation donne de l'oxyde de fer.
Avec
quel gaz le fer réagit-il lors de cette combustion ? Préciser son nom
et sa formule.
Le fer réagit avec le diogygène de l'air ( O2).
Quels sont
les réactifs de cette combustion ?
Les réactifs sont le fer et le dioxygène.
L'oxyde de fer formé lors de la combustion du fer a pour formule Fe3O4.
On veut faire réagir cette poudre de fer avec de l'acide chlorhydrique.
Ecrire
et équilibrer l'équation bilan de cette transformation.
3 Fe(s) + 2O2(g) ---> Fe3O4(s).
Quel
serait la valeur du pH de cette solution d'acide ? pH = 1,5 ou pH =
12,5. Justifier.
Une solution acide
a un pH inférieur à 7 à 25°C. La solution d'acide chlorhydrique a un pH
égal à 1,5.
Il se forme un gaz et des ions fer (II) lors de cette transformation.
Quel
est le test de reconnaissance de l'ion fer (II) ? Préciser le résultat
de ce test.
L'ion fer (II) donne en présence d'hydroxyde de sodium ( ou soude ) un
précipité vert foncé d'hydroxyde de fer (II Fe(OH)2.
Quel
est le gaz qui se produit ? Préciser comment l'identifier.
Il se forme du dihydrogène H2. Présenter une
allumtette enflammée à la sortie du tube à essai, en entend une petite
détonation.
Une éraflure sur une carosserie en acier ( alliage contenant du fer )
provoque l'apparition de rouille
Quels
facteurs accélèrent cette oxydation dans l'air et sur une île
?
En
présence de dioxygène, en milieu humide, le fer s'oxyde. Cette
oxydation est accélérée en présence d'eau salée et par une augmentation
de la température.
|
|
|
Piles
électrochimiques.
Pour construire une pile électrochimique on utilise une solution de
sulfate de cuivre de couleur bleue.
Il se forme un précipité bleu lorsque l'on ajoute de la soude dans la
solution de sulfate de cuivre.
Donner
le nom de l'ion ainsi mis en évidence et préciser sa formule.
L'ion cuivre (II), Cu2+, entouré de molécules
d'eau, est responsable de la couleur bleue de la solution de sulfate de
cuivre.
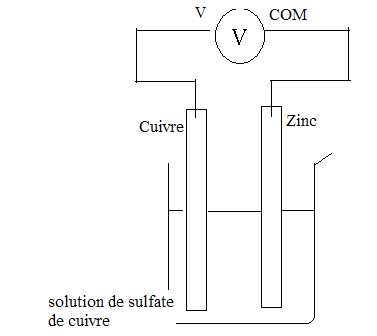
On réalise une pile électrochimique puis on branche un voltmètre à ses
bornes suivant le schéma ci-dessous. On mesure une tension de 0,6 V.
Sous
quelle forme se trouve l'énergie stockée dans la pile ?
Une pile stocke de l'énergie sous forme chimique.
Sous
quelle forme cette énergie est-elle transformée lorsque la pile débite
?
Une pile convertit de l'énergie chimique en énergie électrique.
On constate que la solution se décolore au bout d'un certain temps
d'utilisation de la pile.
A
quoi est due cette décoloration ?
Les ions cuivre (II) sont réduits en cuivre métallique et disparaissent
progressivement de la solution.
La pile s'arrête lorsqu'elle est usée. Pourquoi
?
Au moins l'un des réactifs a été entièrement consommé.
|
.
|
|
Synthèse
d'une espèce chimique.
Le parfum de banane est du essentiellement à une molécule appelée
éthanoate d'isoamyle. Pour synthétiser cette molécule, on prépare un
mélange constitué d'acide éthanoïque, d'alcool isoamylique et quelques
gouttes d'acide sulfurique. On chauffe le mélange dans un montage à
reflux pendant environ 30 minutes. La transformation chimique produit
de l'éthanoate d'isoamyle et de l'eau..
Quels
sont les réactifs et les produits ?
Les réactifs sont l'acide éthanoïque et l'alcool isoamylique ; les
produits sont l'éthanoate d'isoamyle et l'eau.
Ecrire
le bilan de cette transformation chimique.
Acide éthanoïque + alcool isoamylique = éthanoate d'isoamyle + eau.
Citer
un avantage à réaliser la synthèse de cette molécule qui existe dans la
nature.
La molécule obtenue par synthèse coûte moins cher que la même molécule
extraite des bananes.
Réaliser
le schéma annoté de cette expérience.
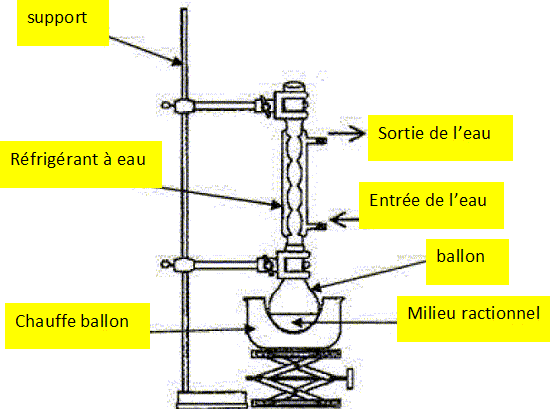
|
Acide
chlorhydrique.
On utilise des batteries contenant de l'acide chlorhydrique pour les
installations solaires.
On dispose de deux solutions d'acide chlorhydrique dont les pH valent
respectivement 2 et 4,5. Quelle est
la solution la plus acide ? Pourquoi ?
La solution la plus acide a le plus petit pH. La solution la plus acide
est la plus concentrée en ion oxonium H+aq.
Citer
deux méthodes permettant de déterminer le pH d'une solution aqueuse.
Le pHmètre donne une valeur précise du pH d'une solution ; le papier
indicateur universel de pH et sa gamme de teintes donne une valeur
approximative du pH ( à une unité près).
Citer
le danger lié à la manipultion des solutions d'acide chlorhydrique
concentrées.
Ces solutions sont corrosives et peuvent provoquer des brûlures.
Que
faire si on reçoit de l'acide chlorhydrique sur les mains ?
Il faut rapidement se laver les mains à grande eau.
Donner
le nom et la formule de l'ion responsable de l'acidité des solutions
aqueuses.
L'acidité est due à la présence de l'ion oxonium H3O+aq,
souvent noté H+aq.
L'acide chlorhydrique contient des ions chlorures. Quel est
le test d'identification des ions chlorures ? Préciser le résultat de
cet test.
En présence d'ion argent Ag+aq, les ions
chlorures Cl-aq donnent un précipité blanc de
chlorure d'argent AgCl(s).
Parfois lors de la charge des batteries il se forme un gaz : le
dihydrogène.
Comment
identifie-t-on ce gaz au laboratoire ?
Présenter une
allumtette enflammée à la sortie du tube à essai, contenant du
dihydrogène, en entend une petite
détonation.
|
|
Sous une chaussure de football, il y a des crampons en aluminium ou à base de fer.
Dans quelle catégorie commune peut-on classer le fer et l'aluminium ?
Le fer et l'aluminium sont des métaux.
L'atome de fer possède 26 charges positives.
Où sont les charges positives dans l'atome ?
Les charges positives sont dans le noyau de l'atome.
Combien l'atome de fer posède-t-il de charges négatives ? Justifier.
L'atome étant électriquement neutre, il possède autant de charges positives que de charges négatives.
Quel nom donne-t-on aux particules chargées négativement ?
Les particules négatives sont des électrons.
Si on place le fer en présence d'acide chlorhydrique, il se produit une réaction chimique.
Entourer le pictogramme de sécurité que l'on trouve sur une bouteille d'acide chlorhydrique.
Quelle est la réaction qui se produit parmi a), b) ou c) ?
a) fer + acide chlorhydrique ---> dihydrogène + solution de chlorure de fer (II)
b) fer + H+ ---> soude + solution de chlorure de fer (II)
c) fer + acide chlorhydrique ---> dihydrogène + solution de chlorure de fer (III)
La proposition a) est correcte.
L'eau de Javel est une solution aqueuse de pH ~11.
L'eau de javel est-elle acide, basique ou neutre ?
Une solution basique a un pH supérieur à 7 à 25°C.
Comment peut-on mesurer le pH d'une solution ?
Le pHmètre donne une valeur précise du pH d'une solution ; le papier
indicateur universel de pH et sa gamme de teintes donne une valeur
approximative du pH ( à une unité près).
|


