|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|
| .
. |
|
|
|
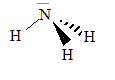 géométrie de la molécule d'après la théorie VSEPR : type AX3E donc pyramide à base triangulaire pH d'une solution : L'ammoniac est donc une base selon Lewis.. couples acide base mis en présence : NH4+ / NH3 et H2O / HO-. NH3 + H2O = NH4+ + HO-. On souhaite préparer une solution tampon à
partir de l'ammoniac. modère la variation du pH, faisant suite à
l'ajout modéré d'acide ou de base forte. Les concentrations de la base NH3 et de son
acide conjugué NH4+ sont
égales : en conséquence pH=pKa =
9,2.
|
|
|
|