|
chlorures métalliques (Capes 63) chlorures alcalins (Capes 75) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||
|
I chlorures métalliques
corrigé |
||
|
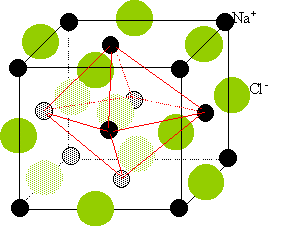
Deux réseaux cubiques à faces centrées, l'un d'ion Na+, l'autre d'ion chlorure Cl-. Ces réseaux se déduisent l'un de l'autre par translation parallèle aux arètes de la maille et de valeur égale à la moitié du coté de la maille. Chaque ion est au centre d'un octaèdre, entouré de 6 ions de signe opposé occupant les 6 sommets.
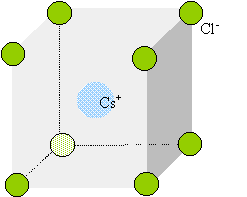
cristaux du type chlorure de césium : Le chlorure de césium : deux réseaux cubiques, déduits l'un de l'autre par une translation parallèle à une diagonale et de valeur égale à la moitié de la diagonale du cube.
Chaque ion Cs+ est équidistant de 8 ions chlorures. Chaque ion Cl- est équidistant de huit ions Cs+. cristaux du type chlorure de calcium, fluorine :
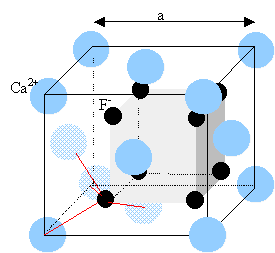
Les ions calcium sont disposés suivant un réseau cubique à faces centrées. Les ions fluorures constituent un réseau cubique de coté ½ a qui s'intercale dans le réseau des ions calcium. le chlorure de sodium est ionique, assemblage d'ions de signes opposés. La cohésion est assurée par des forces d'attraction électrostatiques. Dans les cristaux moléculaires (Al2Br6), la cohésion est assurée par des forces de Van der Waals, plus faibles.
|
||
|
II Les chlorures alcalins.
corrigé configuration électronique des ions Cl-, I- et Na+: Chaque ion a la configuration électronique du gaz rare le plus proche. L'ion Cl- a la configuration de l'argon : 1s2, 2s2 2p6, 3s2 3p6. L'ion I- a la configuration du xénon : 1s2, 2s2 2p6, 3s2 3p63d10,4s2 4p64d10,5s2 5p6. cet ion est isoélectronique de l'ion Cs+. L'ion Na+ a la configuration du néon : 1s2, 2s2 2p6. structure cristalline de NaCl: Deux réseaux cubiques à faces centrées, l'un d'ion Na+, l'autre d'ion chlorure Cl-. Ces réseaux se déduisent l'un de l'autre par translation parallèle aux arètes de la maille et de valeur égale à la moitié du coté de la maille.
coordinence : C'est le nombre d'ions de signe opposé entourant chaque ion, il est ici de six. Chaque ion peut être considéré comme étant au centre d'un octaèdre dont les six sommets sont occupés par des ions de signe opposé. longueur de l'arète de la maille: la maille compte en propre 4 motifs NaCl. masse de la maille : 4 * masse molaire NaCl (kg/mol) / nombre d'Avogadro. masse = 4*58,5 10-3 / 6,023 1023 = 3,88 10-25 kg. volume de la maille a3. (en m3) masse volumique (kg/m3 )=2 163 = 3,88 10-25 / a3. a3 = 3,88 10-25 / 2 163 =0,1796 10-27 m3. a = 5,64 10-10 m. les ions sont considérés comme des sphères en contact: la longueur de l'arète est égale à deux fois la somme des rayons ioniques a= 2*(1,81 +0,97 ) 10-10 = 5,63 10-10 m, résultats cohérents ( écart 1,3%) compacité du cristal : C'est le rapport du volume occupé par les ions au volume de la maille. 4 ions Na+ par maille de rayon 0,97 10-10 m. volume : 4*4 /3 *3,14 * ( 0,97 10-10)3 =1,53 10-29 m3. 4 ions Cl- par maille de rayon 1,81 10-10 m. volume : 4*4 /3 *3,14 * ( 1,81 10-10)3 =9,9 10-29 m3. volume de la maille : (5,63 10-10 )3 =1,78 10-28 m3. compacité : (1,53 10-29 + 9,9 10-29 ) / 1,78 10-28 = 0,64.
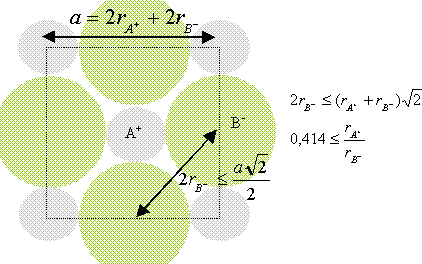
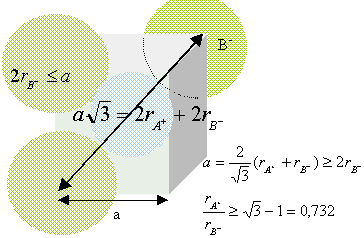
composé binaire AB : conditions pour que AB cristallise dans un réseau type NaCl : représentons une section de la maille, les anions étant plus gros que les cations.
Dans le cas de CsCl, le rapport des rayons ioniques est : 1,67 /1,81 =0,922 CsCl ne cristallise pas dans le type NaCl (voir ci dessus)
cristaux RbI et LiI : faire le rapport des rayons ioniques: pour RbI : 1,47/ 2,2 =0,67 valeur compatible avec les conditions ci dessus ( réseau type NaCl) pour LiI : le rapport des rayons ioniques donne 0,31. l'iodure de lithium ne devrait pas cristalliser dans le type NaCl mais dans celui de la blende ZnS.
retour - menu |