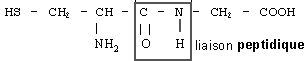|
|
||||||
|
|
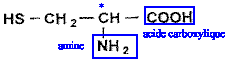
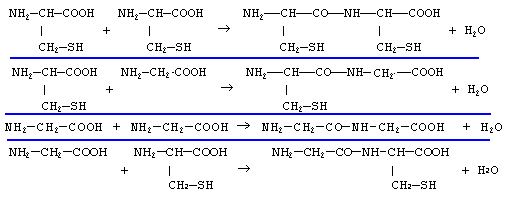
Le glutathion est un tripeptide couramment rencontré dans les cellules végétales et animales. Il joue, dans l'organisme, le rôle de transporteur d'hydrogène. Son hydrolyse conduit à la cystéine, à la glycine et à l'acide glutamique. Les formules semi-développées de la cystéine et de la glycine sont reproduites ci-dessous: 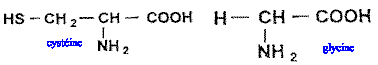
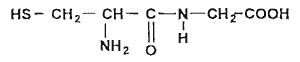
|
|||||
|
Ces deux acides aminés peuvent conduire à 4 dipeptides différents.
|
||||||
|
En 1818, le baron Jacques THENARD synthétise une espèce chimique : l'eau oxygénée dont le principe actif est le peroxyde d'hydrogène H2O2. L'eau oxygénée est vendue comme antiseptique en pharmacie. Elle peut être utilisée pour nettoyer les lentilles cornéennes ou les plaies hémorragiques. L'eau oxygénée a des propriétés oxydoréductrices par la mise en œuvre des couples H2O2 / H2O et O2 / H2O2.
- pipettes jaugées de volumes : 1 mL ; 5 mL ; 10 mL ; 20 mL - fioles jaugées de volumes : 50 mL ; 100 mL ; 250 mL ; 1 000 mL - béchers de volumes : 50 mL ; 100 mL ; 250 mL.
corrigé Equation bilan de dismutation de l'eau oxygénée : 2 H2O2 --> 2 H2O + O2 Par définition, 1 litre de solution d'eau oxygénée de concentration "110 volumes" peut libérer V = 110 L de dioxygène, dans les conditions normales de température et de pression. T = c * 11,2 Donc, pour une solution d'eau oxygénée de concentration c = 1 mol.L-1 : T = 11,2 volumes. Donc une solution commerciale de titre T0 = 110 volumes, a pour concentration molaire c0 = 110/11,2= 9,8 mol. L-1. La solution mére est diluée 10 fois : donc le volume de solution mère à prélever est 100 /10 = 10 mL On prélève V0 = 10 mL de solution commerciale à l'aide d'une pipette jaugée de 10 mL (et d'une poire à pipeter) ; on verse dans une fiole jaugée de 100 mL et l'on complète avec de l'eau distillée jusqu'au trait de jauge ; on agite pour homogénéiser le mélange.
|
||||||
|
corrigé . ''c'' est la célérité (vitesse) de la lumière dans le vide. Elle s'exprime en mètres par seconde (m.s-1). l = c / n = 3 108 / 3,22 1013 =9,32 10-6 m = 9,32 mm. Le domaine de longueurs d'onde du rayonnement visible est compris entre 0,4 et 0,8 µm (environ). Le rayonnement précédent a une longueur d'onde nettement supérieure : c'est un rayonnement infrarouge. L'énergie E d'un photon de fréquence v est définie par E = h. n; (h est la constante de Planck) Pour le rayonnement étudié : E = 6,62.10-34
x 3,22.1013 = 2,13.10-20 J.
L'absorption des rayons X par un corps dépend de : la nature, la masse volumique et l'épaisseur du matériau, la longueur d'onde des rayons X. Les os absorbent les rayons X : derrière eux, la plaque photographique n'est pas impressionnée, ils apparaissent donc blancs sur le cliché. Un atome absorbe d'autant plus les rayons X que son numéro atomique Z est élevé. Le métal le plus approprié pour s'en protéger est donc le plomb (Z = 82). Les rayons X ont un fort pouvoir ionisant sur les tissus biologiques donc, plus la dose est importante plus le nombre de cellules détruites est élevé. Effets biologiques possibles sur le corps humain, après une exposition prolongée : cancers, stérilité ; mutations biologiques ; malformations du fœtus chez la femme enceinte, leucémies.
|
||||||
|