|
(6,5 points) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
L'arôme de banane est dû : - soit à la présence d'extraits naturels de banane; - soit à la présence d'un composé artificiel, l 'acétate de butyle (ou éthanoate de butyle).
I. Composé naturel ou arôme artificiel ? Donner une des raisons qui font qu'un industriel puisse plutôt avoir recours à l'utilisation du composé artificiel. II. Questions préliminaires. L 'acétate de butyle a pour formule semi-développée : CH3-COO-CH2-CH2-CH3.
III. Synthèse de l'acétate de butyle au laboratoire . On se propose de synthétiser au laboratoire l'acétate de butyle (E) à partir des composés A et B et de réaliser un suivi cinétique de cette synthèse. Pour cela, dans un becher placé dans un bain d'eau glacée, on introduit : - un volume VA = 5,8 mL d'acide carboxylique A ; - un volume VB = 9,2 mL d'alcool B (soit 0,10 mol) ; - quelques gouttes d'acide sulfurique concentré. Données :
IV. Suivi de la synthèse par titrage de l'acide restant : On agite le mélange initial et on répartit avec précision le mélange dans 10 tubes à essais placés préalablement dans un bain d'eau glacée ; chaque tube contient ainsi un dixième du volume du mélange initial. On munit chaque tube d'un refrigérant. On place ensuite simultanément tous les tubes dans un bain thermostaté à 80°C et on déclenche alors le chronomètre (instant de date t0 = 0 s). Afin de réaliser un suivi temporel de la synthèse de l'acétate de butyle, on dose, à des dates déterminées, les acides restants (acide sulfurique et acide carboxylique A) dans chacun des tubes par une solution de soude de concentration molaire apportée c = 1,0 mol. L-1, en présence d'un indicateur coloré. Avant chaque titrage, on plonge le tube dans un bain d'eau glacée. Une étude préalable a permis de connaître le volume de soude nécessaire au titrage de l'acide sulfurique présent dans chacun des tubes. Les résultats expérimentaux des titrages successifs sont donnés ci-dessous. On désigne par Veq le volume de soude nécessaire au titrage de l'acide carboxyligue seul.
V. Évolution temporelle de l'avancement de la synthése organique : À partir des résultats expérimentaux, il est donc possible de tracer la courbe donnant l'évolution temporelle de l'avancement x de la réaction de synthèse pour le mélange initial. La courbe est donnée ci-dessous: 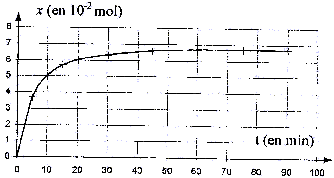
acide éthanoïque ( acétique) + butan-1-ol = acétate de butyle + eau L'eau glacée provoque un blocage cinétique de la réaction. L'acide sulfurique H2SO4 catalyse à la fois l'estérification et l'hydrolyse de l'ester. Qté de matière d'acide éthanoïque : masse (g) / masse molaire (g/mol) masse (g) = masse volumique ( g/mL) * volume (mL) = mA VA. nA = mA VA/ MA = 5,8*1,05 / 60 = 0,1 mol. Le mélange initial est équimolaire : les réactifs sont en proportions stoéchiométriques. A partir de 0,1 mol d'acide et de 0,1 mol d'alcool, on peut obtenir au mieux 0,1 mol d'ester si la réaction est totale. xmax = 0,1 mol.
Au cours du temps la quantité de matière d'acide A diminue ( formation de l'ester) et en conséquence la quantité d'acide restant dans le milieu réactionnel est de plus en plus faible : il en sera de même de la quantité de matière de soude à l'équivalence. A l'équivalence les quantité de matière d'acide et de soude sont dans les proportions stoéchiométriques. Avant l'équivalence l'acide est en excès dans le bécher ; après l'équivalence, la base est en excès dans le milieu réactionnel. Dans un tube : acide initial 0,1 /10 = 0,01 mol a réagi à la date t : x mol ; acide restant : 0,01 - x mol x : avancement en mol de la réaction d'estérification. à l'équivalence : Qté de matière d'acide restant = Qté de matière de base versée 0,01 - x = CB Véq d'où x = 0,01 -CB Véq dans le bécher ( 10 tubes) : x = 10(0,01 -CB Véq
) soit x=0,1 - 10 CB Véq.
taux d'avancement final : t = xfin /xmax = 0,067 / 0,1 = 0,67. t est inférieur à 1 : la réaction n'est pas totale. transformation lente , l'équilibre est atteint à t >50 heures. Lorsque l'équilibre est atteint : durant Dt secondes il se forme autant de mole d'ester ( sens direct) qu'il n'en dsiparaiît par hydrolyse : la composition du mélange n'évolue plus. Travailler à température plus élevée, accélére la formation de l'ester Ajouter l'un des réactifs en excès, ou éliminer le produit le plus volatil ( l'eau dans ce cas) au fur et à mesure qu'il se forme permet d'aumenter t. La réaction sera totale si on utilise à la place de l'acide éthanoïque: le chlorure d'éthanoyle CH3-COCl ou l'anhydride éthanoïque : CH3-CO-O-CO-CH3.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||