On désire déterminer la distance focale d'une lentille mince de vergence 5d sur un banc d'optique gradué en cm.
- Cette lentille est-elle convergente ou divergente? Justifier. Quelle est sa distance focale?
- Dans la liste suivante rayer le matériel
inutile à sa détermination :
condenseur, lentille convergente, double décimètre, lentille divergente, écran, source de lumière.
Doit on compléter cette liste? Justifier. - Comment peut-on reconnaître rapidement une lentille convergente d'une lentille divergente?
corrigé
La distance focale est l'inverse de la vergence : f= 1/5 = 0,2 m = 20 cm.
double décimètre, lentille divergente sont inutiles
Il faut un banc d'optique et un objet ( lettre F ou chiffre 1 découpée sur un support) afin d'obtenir une image sur l'écran
Une lentille convergente à les bords minces et sa partie centrale bombée.
Une lentille divergente à les bords plus épais que la partie centrale.
Pour alimenter une lampe (6V ; 100 mA) on utilise une alimentation stabilisée 0 à 30V.
- Faire le schéma du montage à réaliser pour mesurer la tension aux bornes de la lampe.
- On dispose des calibres suivants : 100 mV; 200 mV; 0,5V ; 5V ; 10V, 20V ; 220V. Lequel utilisez vous?
- L'alimentation stabilisée ne fonctionne pas. Quelles vérifications faut-il réaliser pour diagnostiquer la panne?
- On se propose d'utiliser à la place un générateur délivrant une tension fixe de 15 V. Quelle est la valeur de la résistance à monter en série avec la lampe afin que celle ci fonctionne de façon nominale.
- Choisir le conducteur ohmique le mieux adapté
parmi les valeurs normalisées des
résistances suivantes:
47 W et 1W ; 100 W et 1W ; 100 W et 0,5W ; 220 W et 1W ;
corrigé
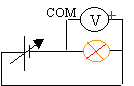
10V: plus grand que 6 V et le plus proche possible de 6V.
vérifier que l'alimentation est bien branchée et puis ensuite vérifier l'état du fusible de protection.
remplacer le fusible si nécessaire.
vérifier à l'aide
d'un volmètre, la tension de sortie de
l'alimentation.
La tension aux bornes de
la lampe doit être égale à
6V.
En conséquence la tension aux bornes du résistor en série est 9 V.
L'intensité du courant est 0,1 A: la résistance est : 9/0,1 = 90 ohms.
on va choisir : 100 W et 1W
P = U Imaxi = R I² maxi d'où Imaxi = racine carrée(1/100)=0,1A
avec 100 W et 0,5W l'intensité maximale admissible serait : racine carrée(0,5/100)=0,07A
la résistance ne pourrait supporter sans dommages 0,1A.
A partir d'une solution d'acide chlorhydrique de concentration 0,01 mol/L on désie préparer 1L d'une solution de concentration 10-4 mol/L. Dresser la liste du matériel à utiliser. Décrire le mode opératoire.
corrigé
100 = volume final / volume à prélever
il faut donc prélever 10 mL , à la pipette jaugée surmonter d'un pipeteur, de la solution mère et les placer dans une fiole jaugée de 1L. Compléter jusqu'au trait de jauge avec de l'eau distilée.
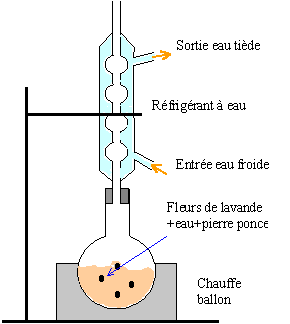
- Pour préparer un ester on chauffe à reflux le mélange réactionnel pendant 45 min. Nommer les différentes parties du montage et indiquer le sens de la circulation de l'eau.
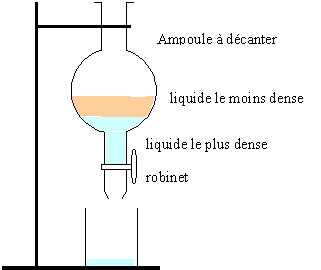
- On extrait ensuite la phase organique à l'aide d'une ampoule à décanter. Dessiner l'ampoule à décanter en indiquant où se trouve la phase aqueuse et l'ester de densité d=0,87.
corrigé
l'ester occupe la partie supérieure de l'ampoule à décanter.
- On désire préparer 1 L de solution
d'acide nitrique de concentration 0,1 mol/L à
partir d'une solution commerciale. La bouteille de la
solution commerciale comporte les indications suivantes:
masse volumique : 1400 g/L
pourcentage en masse d'acide pur : 65%
masse molaire de l'acide nitrique : 63 g/mol
Montrer que la concentration de la solution commerciale est 14 ,4 mol /L - Quel volume de solution commerciale doit on
prélever?
corrigé
Dans cette solution la masse d'acide pur est : 1400*0,65 = 910 g
Qté de matière d'acide (mol) = masse (g) / masse molaire (g/mol) = 910 / 63 = 14,4 mol dans 1L
facteur de dilution : 14,4 / 0,1 = 144
144 = volume finale de la solution fille / volume à prélever de la solution mère
il faut donc prélever : 1 /144 = 6,94 mL
retour - menu