combustion de A dans le dioxygène :
CxHyOz + (x+¼ y -½ z) O2 donne x
CO2 + ½ y H2O
B et C sont l'eau et le dioxyde de carbone.
B et C en quantité molaire égale : x=
½ y ou y=2x.
CxH2xOz
Quantité de matière de dioxygène :
168 /24 = 7 mol
7 = x + ¼ y + ½ z = x + ½ x + ½ z =
1,5 x + 0,5 z
7 =1,5 x - 0,5 z
(2)
Masse molaire de A : M =12 x+ 2x+16 z =14 x +16 z
pourcentage massique de carbone : 12 x / M = 0,6976
12 x = 0,6976 M = 0,6976 (14 x+16 z) = 9,76 x + 11,16
z
2,24 x = 11,16 z ou x = 5
z
repport dans (2) : 7
= 7,5 z -0,5 z ; z=1 ; x=5 ; y=10
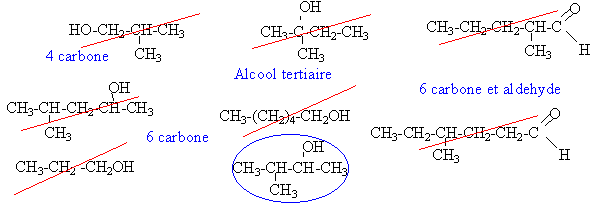
C5H10O
masse molaire de A : 12*5 +
10+16 = 86 g/mol
pour obtenir un aldehyde ou une
cétone , par oxydation ménagée , on
doit partir d'un alcool primaire ou secondaire.
Le squellette carboné n'est
pas modifié.
retour - menu