sciences
physiques et industrielles
exercice
suivant : éthanoate de penthyle
Une solution commerciale S0 utilisée pour déboucher les éviers est constituée essentiellement d'une base notée B. L'objectif de cet exercice est de déterminer si la base est forte ou faible et de calculer sa concentration. Sur l'étiquette on lit " danger : produit corrosif". On dispose du matériel suivant :
pHmètre avec électrodeet système d'agitation ; fioles jaugées ( 50mL, 100 mL, 200mL) ; poire aspirante ou pipeteur ; pipettes jaugées (1 mL, 5 mL, 10 mL, 20 mL) ; éprouvettes graduées ( 1mL, 5 mL, 10 mL, 20mL) ; burettes 25 mL et béchers.
eau distilée; solution commerciale du produit déboucheur ; solution acide chlorhydrique à 0,05 mol/L ; solution tampon pH=7 ; solution tampon pH =4 ; indicateurs colorés.
étude d'une propriété de la base B:
- On prépare à partir de S0 une solution diluée notée S, de concentration C=C0/200. Indiquer quels matériels et quels produits il faut utiliser pour cette dilution.
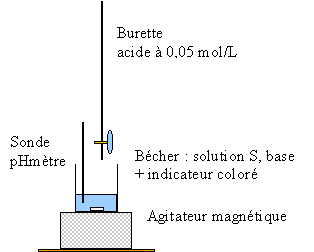
- Afin de savoir si la base B est forte ou faible on verse progressivement une solution d'acide chlorhydrique dans un bécher contenant initialement 20 mL de la solution S. On mesure le pH du milieu réactionnel en fonction du volume Va d'acide ajouté. Faire un schéma légendé du dispositif.
- Quelle est l'utilité d'une solution tampon dans l'étude précédente, Indiquer les propriétés d'une solution tampon.
- En exploitant la courbe ci dessous dire si la base B
est faible ou forte.
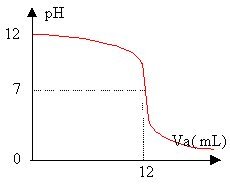
- Citer une base courante susceptible d'être présente dans la solution commerciale.
détermination des concentration des solutions S et S0:
- Donner la définition de l'équivalence acido-basique. Donner la relation liant concentrations et volumes.
- Déterminer graphiquement le point équivalent; en déduire les concentration C et C0.
choix d'indicateurs colorés :
Il est possible de choisir correctement un ou plusieurs indicateurs colorés pour déterminer le point d'équivalence.
- On considère un indicateur coloré l'hélianthine dont le pKa est 3,6 . Sa forme acide est rouge et sa forme basique est jaune. Qu'appelle-t-on zone de virage d'un indicateur coloré de pH ?
- On utilise une solution incolore dont le pH vaut 5.
Quelle teinte prend t'elle lorsqu'on lui ajoute deux
gouttes de l'indicateur coloré ci-dessus?
Justifier à l'aide des données
ci-dessous.
indicateur couleur forme acide zone de virage couleur forme basique hélianthine rouge 3,1 - 4,4 jaune bleu de bromothymol jaune 7 - 8,6 bleu phénolphtaléine incolore 8,2 - 10 rose violet
- Quel est parmi ces indicateurs celui qui est le mieux
adapté au dosage?
- Quelle conséquence entraînerait l'utilisation
des autres indicateurs?
corrigé
Si on choisit un volume final de 200 mL (fiole jaugée) il faut prélever 1 mL de la solution commerciale S0 à l'aide d'une pipette jaugée surmontée d'un pipeteur. Placée dans la fiole jaugée et compléter avec de l'eau distilée jusqu'au trait de jauge.
Les solutions tampon servent à étalonner le pHmètre.
propriètés d'une solution tampon :
- modére les variation de pH lors de l'ajout modéré d'une base ou d'un acide fort.
- le pH ne varie pa par dilution.
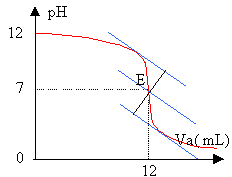
Le pH est voisin de 7 à l'équivalence : B est une base forte, l'acide étant fort.
B est sans doute l'hydroxyde de sodium ou soude.
A l'équivalence acido-basique les quantités de solution basique et de solution acide ont été ajoutés en proportions stoéchiométriques.
CaVa=CbVb
Cb = 0,05*12 /20 = 0,03 mol/L
en tenant compte du facteur de dilution : C0 = 0,03*200 = 6 mol/L.
Un indicateur coloré est une solution contenant un couple acide base faible : la forme HA et la forme A- , base conjuguée ont des teintes différentes.
La zone de virage de l'indicateur coloré est un intervalle de pH, centré sur le pKa ( pKa-1 ; pKa+1) dans lequel l'indicateur coloré change de teinte. Le chiffre 1 correspond à log 10. L'oeil perçoit une teinte nette lorsque la forme prédominante est en quantité au moins 10 fois supérieure à l'autre forme conjuguée.
hélianthine : rouge [2,6 - 4,6 ] jaune
à pH=5 l'hélianthine prend une teinte jaune.
La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent : le bleu de bromothymol est le plus approprié dans ce cas.
Avec l'hélianthine, le volume d'acide serait légérement inférieur à 12 mL; avec la phénolphtaléine, le volume d'acide serait un peu supérieur à 12 mL.
Mais pour revenir à C0, on multiplie par 200 : l'erreur commise sur C serait multipliée par 200.