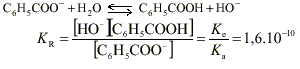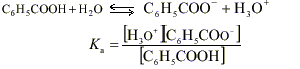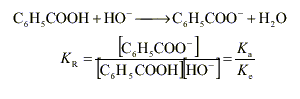| |
acide benzoïque - ion benzoate En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||
|
|
benzoate de sodium
|
Un bécher contient V = 100 cm3de solution de benzoate de sodium de concentration c = 0,01 mol L-1. (solution notée S2).On mesure le pH et on trouve pH = 8,1.
|
|||||
| |
C6 H5 COONa(s) donne Na + + C6 H5 COO - . Le pH d’une solution est défini par pH = -log [ H3 O +]. Le pH mesuré est >7, la solution est donc basique. C’est l’ion benzoate C6 H5 COO - qui a un caractère basique. Dans le ca d'une base forte (réaction totale avec l’eau) de concentration c = 0,01mol.L -1 , le pH vérifierait la relation pH = 14 + lg c ( relation valable pour des concentrations comprises entre 10 -5 et 10 -2 mol.L -1 ) soit pH= 12. la mesure indique pH = 8,1 : l’ion benzoate est une base faible ; la réaction avec l’eau n’est pas totale elle est limitée ce qui se traduit par l’équilibre chimique suivant :
pH = 5,5 si pH> pKa la base conjuguée prédomine ici pKa = 4,2 donc c’est l’espèce ion benzoate C6 H5 COO - qui prédomine à pH=5,5
|
||||||
|
acide benzoïque |
On mesure le pH d'une solution S1 d'acide benzoïque de concentration c1 =0,01 mol.L -1 . Le pH-mètre indique 3,1.
corrigé |
||||||
| |
Ici le pH est égal à 3,1 donc [H3O + ] = 10 -3,1 mol.L -1 ; [H3O + ] est inférieure à c donc la réaction de l'acide benzoïque avec l'eau est limitée. L'acide benzoïque est un acide faible.
L'acide le plus fort est l'acide benzoïque et la base la plus forte l'ion hydroxyde, d'où :
Kr = 10-4,2 / 10-14 = 10 9,8. La constante de réaction est très grande : la réaction peut être considérée comme totale.
|
||||||
|
solution tampon |
On réalise une solution S en mélangeant 20 mL de solution S1 et 20 mL de solution S2.
corrigé |
||||||
| |
Les deux solutions S1 et S2 ont la même concentration et on en prélève le même volume ; l'acide benzoïque et l'ion benzoate ont donc même concentration dans le mélange. Or pH = pKa + lg [Base]/[Acide conjugué], doncpH = pKa= 4,2. Cette solution est une solution tampon:
|
||||||
|
|
|