- Le numéro atomique de
l'élément iode est Z=53 :
- En déduire sa configuration électronique fans son état fondamental. Combien cet atome possède-t-il d'électrons de valence ? D'électrons de nombre quantique secondaire égal à 2 ?
- Donner le schéma de Lewis de l'atome d'iode. A quel famille d'éléments chimiques appartient-il ? Citer deux autres éléments appartenant à cette famille.
- Donner le schéma de Lewis de l'ion iodure I-, du diiode I2 et de l'ion iodate IO3- ( l'iode est l'atome central) En déduire la géomètrie de l'ion iodate en précisant l'angle approximatif entre deux liaisons iode-oxygène de cet ion.
- Sous quel état physique trouve-t-on le diiode pur à 25°C. Pourquoi sa solubilité dans l'eau est-elle faible ? - Energie d'attachement électronique de
l'iode : on se propose de déterminer
l'énergie d'attachement électronique de
l'iode en utilisant les règles de Slater. Dans
cette approximation, l'énergie d'un
électron de nombres quantiques n et l est
donné par la relation En,l = -13,6
[Z* / n*]2 en eV, où n* est le
nombre quantique apparent. On pose Z*=Z-s,
où s est la constante
d'écran.

- Rapeler la définition de l'énergie d'attachement électronique et écrire l'équation bilan de la réaction associée.
- Donner la signification physique de Z*.
- En utilisant les coefficient de Slater donnés ci-dessus, déterminer en eV l'énergie d'un électron de la couche de valence de l'atome d'iode.
- Déterminer de même l'énergie d'un électron de la couche de valence de l'ion iodure.
- Calculer l'énergie d'attachement électronique de l'iode en précisant clairement le raisonnement. Comment expliquer l'écart important par rapport à la valeur expérimentale de - 3,44 eV ?
- Comment évolue l'énergie d'attachement électronique quand on se déplace de la gauche vers la droite dans une même période de la classification périodique ? Justifier.
corrigé
configuration électronique de l'atome de diiode dans son état fondamental :
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5.
7 électrons de valence ( 2 électrons 5 s et 5 électrons 5p)
20 électrons de nombre quantique secondaire l=2 ( sous-couches 3d et 4 d )
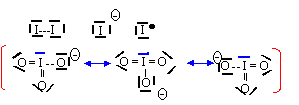
L'ion IO3- est du type AX3E et a une structure pyramidale à base triangulaire avec des angles de liaisons de 109,5°.
le diiode se trouve sous forme solide cristallisé à la température de 20°C ; de couleur gris violet.
Il est peu soluble dans l'eau, la molécule de diiode est apolaire alors que l'eau est un solvant polaire.
l'énergie d'attachement électronique, notée Eatt est l'énergie interne standart de réaction à la température de 0 K, associée à la réaction : I(gaz) + e- --> I-(gaz)
C'est l'énergie de formation de l'ion I- par fixation d'un électron sur l'atome gazeux d'iode.
Un électron d'un atome polyatomique est soumis à l'attraction du noyau positif ( charge Ze) et à la répulsion de tous les autres électrons négatifs : tout se passe comme si l'électron était soumis à un noyau fictif de charge +Z*e. (Z* e : charge effective ressentie par un électron). Pour calculer Z* on retranche à Z une charge fictive s, appelle constante d'écran, représentant la répulsion moyenne des autres électrons.
Slater :
configuration électronique de l'atome de diiode dans son état fondamental : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5.
Z*5s,5p = 53-(2*1+8*1+18*1+18*0,85+6*0,35)= 7,6 ; n*=4 ;
énergie d'un électron de la couche de valence : E5s,5p= -13,6[7,6/4]2= -49,1 eV.
configuration électronique de l'ion iodure dans son état fondamental : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6.
Z*5s,5p = 53-(2*1+8*1+18*1+18*0,85+7*0,35)= 7,25 ; n*=4 ;
énergie d'un électron de la couche de valence : E'5s,5p= -13,6[7,25/4]2= -44,7 eV.
Eatt = énergie de l'ion I-(gaz) - énergie de l'atome I(gaz)= E(I-gaz) - E(I gaz)
énergie de l'atome I(gaz) = énergie des électrons de coeur + énergie des électrons de valence= E0+ 7*(- 49,1)
énergie de l'ion I-(gaz) = énergie des électrons de coeur + énergie des électrons de valence= E0+ 8*(- 44,7)
Eatt =8*(- 44,7)-7*(- 49,1) = -13,9 eV.
Le modèle de Slater est approximatif ( d'où l'écart de valeur par rapport à la valeur expérimentale -3,44 eV)
les électrons ns et np n'ont ni la même constante d'écran, ni la même énergie.
On se propose de déterminer l'ordre et la constante de vitesse de la réaction d'oxydation des ions iodures par les ions peroxodisulfates S2O82- en solution aqueuse.
- Réaction étudiée :
- Ecrire l'équation bilan de la réaction (1) entre les ions iodures et les ions peroxodisulfates. Expliciter puis calculer sa constante d'équilibre. Conclure.
- Dans cette réaction seule la solution de diiode est colorée. Préciser cette couleur. - Suivi de la réaction : la
réaction (1) sera suivie en mesurant l'absorbance
A de la solution au cours du temps. On rappelle la loi de
Berr-Lambert donnant l'absorbance A d'une solution de
I2 à la concentration c mol/L
placée dans une cuve d'épaisseur L ( cm) :
A=elLc
où el est le
coefficient d'extinction molaire de I2
à la longueur d'onde l.
- Si on souhaite vérifier cette loi, comment choisit-on la longueur d'onde de travail ? Quelle courbe doit-on tracer auparavant pour déterminer expérimentalement cette longueur d'onde ?
- Faire le lien entre cette longueur d'onde et la couleur du diiode.
- A la longueur d'onde de 454 nm on mesure l'absorbance A de différentes solutions de diiode préparées à partir d'une solution mère de diiode à 2 10-3 mol/L. On obtient la courbe suivante :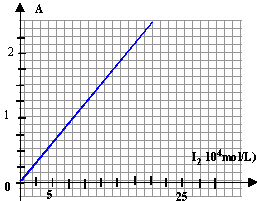
- Expliquer comment vous prpareriez 20 mL de la solution de diiode à 5 10-4 mol/L à partir de la solution mère.
- La loi de Beer-Lambert est-elle vérifiée ? - Etude cinétique :on suppose que la
réaction étudiée admet un ordre
partiel p par rapport aux ions iodures et un ordre
partiel n par rapport aux ions peroxodisulfates. 0
l'instant t=0 on mélange 25 mL de iodure de
potassium à 0,25 mol/L et 15 mL de solution de
peroxodisulfate d'ammonium à 6,25 10-3
mol/L.
- Calculer les concentrations des réactifs juste après le mélange et avant que ne débute la réaction. Montrer sans calcul supplémentaire que ces conditions initiales permettront déterminer l'ordre de la réaction par rapport aux ions peroxodisulfates. Donner alors l'expression de la constante apparente de vitesse.
- En faisant un bilan de matière, déterminer la concentration en ion peroxodisulfate à un instant t en fonction de la concentration en diiode à ce même instant.
- En supposant la réaction d'ordre 1 par rapport aux ions peroxodisulfate, établir quelle fonction de sa concentration [S2O82-] il faut tracer expérimentalement pour le vérifier. - Résultats :
- Expliquer comment à partir de la mesure de l'absorbance du mélange au cours du temps, on pourra déterminer à tout instant la concentration en ions S2O82-.
-On obtient les résultats suivants :
Montrer que ces résultats sont en accord avec une cinétique d'ordre 1. Tracer la courbe adéquate après avoir présenté un tableau de valeurs.t(min) 0 4 8 12 16 A 0 0,349 0,67 0,94 1,178
- Calculer la constante apparente de vitesse.
E0(I2/I-) = 0,62 V ; E0(S2O82-/SO42-) = 2,01 V ; RT/F ln x = 0,06 ln x
corrigé
S2O82-+2e-= 2SO42- réduction ; E1 = 2,01+0,03 log[S2O82-] / [SO42-]2)
2I- = I2 + 2e- oxydation ; E2 = 0,62+0,03 log[I2] / [I-]2)
S2O82-+2I- -->2SO42- + I2 (1) K = [SO42-]2 [I2] / ( [I-]2 [S2O82-] ))
A l'équilibre thermodynamique les potentiels E1 et E2 sont égaux :
2,01+0,03 log([S2O82-] / [SO42-]2) = 0,62+0,03 log[I2] / [I-]2)
(2,01-0,62) / 0,03 = log K d'où K= 2,1 1046.
K est grand, donc cette réaction est thermodynamiquement favorisée.
Elle est quantitative et en fin de réaction le réactif limitant sera entièrement consommé.
La solution de diiode est brune si elle est concentrée ; jaune-orange si elle est plus diluée.
On doit travailler à une longueur d'onde l telle que l'absorption de la substance absorbante soit maximale. Il faut alors tracer le spectre de la substance absorbante , c'est à dire la courbe A=f(l). Cette courbe présente au moins un pic d'absorption.
Les radiations absorbées sont en général complémentaires de la couleur de la solution absorbante : le diiode absorbe à 454 nm ( couleur bleue ) , couleur complémentaire du jaune-orangé de la solution de diiode diluée.
facteur de dilution : [solution mère]/ (solution fille]=2 10-3 / 5 10-4 = 4
il faut donc prélever 20/4 = 5 mL de la solution mère à 2 10-3 mol/L pour préparer 20 mL de solution fille à 5 10-4 mol/L
utiliser une fiole jaugée de 20 mL et compléter avec de l'eau distillée jusqu'au trait de jauge.
La courbe A=f([I2]) est une droite passant par l'origine et de coefficient directeur p= 2,5 / 20 10-4 = 1250 L mol-1.
La loi de Berr-Lambert est donc bien vérifiée.
cinétique :
la vitesse s'écrit : v = k[I-]p[S2O82-]n.
concentrations initiales des réactifs : [I-]0=25*0,25/(25+15) = 0,156 mol/L
[S2O82-]0= 15*6,25 10-3 / ( 25+15) = 2,34 10-3 mol/L
Les ions iodures sont en large excès : il y a dégénérescence de l'ordre par rapport aux ions iodures.
la vitesse peut s'écrire : v = kapp[S2O82-]n avec kapp = k[I-]0p.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
à tout instant : [S2O82-] =[S2O82-]0 -[ I2]
en supposant la réactiond'ordre 1 par rapport à S2O82-, la vitesse s'écrit :
v = - d [S2O82-] / dt = kapp[S2O82-]
d [S2O82-] / dt + kapp[S2O82-] = 0
solution de cette équation différentielle : [S2O82-] = B exp( -kappt )
avec à t=0 [S2O82-]0 = B e0= B ; [S2O82-] =[S2O82-]0 exp( -kappt )
ln[S2O82-] =ln [S2O82-]0 -kappt
tracer la courbe ln [S2O82-] = f(t) : droite de pente -kapp si l'hypothèse n= 1 est vérifiée.
résultats :
[S2O82-] =[S2O82-]0 - [ I2] avec A = 1250 [ I2] et [S2O82-]0= 2,34 10-3 mol/L
[S2O82-] =2,34 10-3 - A/1250 = 2,34 10-3 - 8 10-4 A
à partir de la mesure de l'absorbance du mélange au cours du temps on peut trouver [S2O82-]
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
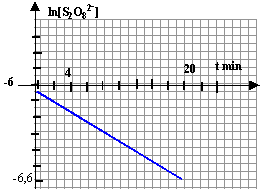
cette courbe est une droite, donc l'hypothèse n=1 est vérifiée. kapp = 3,2 10-2 min-1.
- On fait réagir l'acide iodhydrique HI en
solution aqueuse en large excès sur le
2-méthylpropan-1-ol, noté A. On obtient un
composé B de formule brute
C4H9I.
-Donner la représentation topologique de A.
- Ecrire l'équation de la réaction et proposer un mécanisme pour la formation de B sachant que l'acide iodhydrique est un acide fort.
- Pourquoi travaille-t-on avec un large excès d'acide iodhydrique ? - Dans une ampoule de coulée, on introduit 9,56
g d B dans 40 mL d'éther éthylique anhydre
(éthoxyéthane). On verse cette solution
goutte à goutte dans un ballon tricol, contenant
1,9 g de magnésium et quelques cristaux de diiode.
Le ballon est également surmonté d'un
réfrigérant prolongé d'un tube garni
de chlorure de calcium. L'addition terminée on
chauffe à reflux pendant 25 min.
- Ecrire la réaction qui a lieu. Nommer le produit C obtenu.
- Pourquoi l'éther doit-il être anhydre ? Citer une méthode permettant de sécher l'éther pour le rendre anhydre.
- A quoi sert le tube de chlorure de calcium ?
- A quoi servent les cristaux de diiode ?
- Que signifie chauffer à reflux ?
- Calculer et discuter les quantités de magnésium et de B utilisées ? - On refroidit, puis on ajoute goutte à goutte
dans le tricol une solutio de 4,5 g de butanal dans 10 mL
d'éther anhydre. Après hydrolyse acide,
décantation et purification, on obtient 3,5 g d'un
liquide incolore noté D.
- Donner le mécanisme de la réaction entre C et le butanal et écrire le bilan de l'hydrolyse acide. Nommer le composé D.
- Quel est l'intérêt de se placer en milieu acide au cours de l'hydrolyse ?
- Représenter dans l'espace les stéréisomères de configuration de D et donner la configuration absolue des atomes de carbone asymétriques. On précisera l'ordre de priorité des substituants.
- La réaction entre C et le butanal est-elle stéréosélective ? Justifier et en déduire si le liquide D possède une activité optique.
- Calculer le rendement de l'opération ( passage de B à D).
- L'alcool D est finalement oxydé en la 2-méthylheptan-4-one par le permanganate de potassium en milieu acide. Ecrire l'équation bilan de la réaction. (MnO4- / Mn2+)
I= 126,9 ; Mg = 24,3 ; O=16 ; C= 12 ; H= 1 g/mol.
corrigé
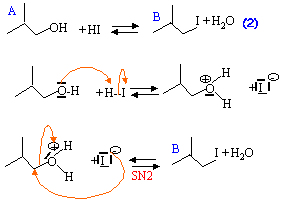
On utilise un excès de HI car la réaction (2) est un équilibre : il faut la déplacer dans le sens de la formation de B.
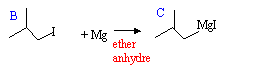
C est l'iodure de 2-méthylpropanemagnésium
L'éther doit être anhydre car l'eau détruit l'organomagnésien C par un réaction acido-basique totale. L'éther est séché sur des zéolithes, comportant de nombreuses cavités qui absorbent l'eau.
Le tube à chlorure de calcium sert à pièger l'eau, présente sous forme de vapeur dans l'air. CaCl2 anhydre est un bon agent désséchant.
Les cristaux de diiode servent à démarrer la réaction.
Chauffage à reflux : chauffer le mélange à la température d'ébullition du solvant ( ici l'éther). Ce dernier se vaporise et les vapeurs se condensent dans le réfrigérant. On augmente ainsi la vitesse de la réaction sans pertes de matière.
Quantités de matière :
B : masse B / masse molaire B = 9,56 / 183,9=52 mmol
magnésium : 1,9/24,3 = 78 mmol. en excès
le dérivé halogéné est introduit progressivement afin d'éviter la réaction de Wurtz, réaction de l'organomagnésien avec l'halogénoalcane de départ.
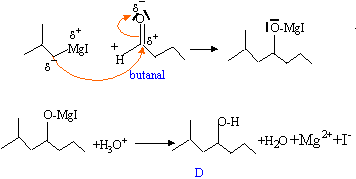
le composé D est le 2-méthylheptan-4-ol.
en milieu acide onévite la précipitation de l'hydroxyde de magnésium Mg(OH)2. La séparation des phases aqueuse et éthérée est ainsi plus facile.
Les stéréoisomères de configuration de D sont deux énantiomères.
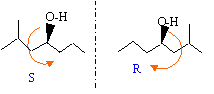
ordre de priorité des substituants : -OH > -CH2-CH(CH3)2 > CH2-CH2-CH3 > H
le groupe carbonyle est plan : l'attaque de l'organomagnésien sur le carbone électrophile est équiprobable de part et d'autre de ce plan. La réaction entre C et le butanal n'est pas stéréosélective. Le liquide D obtenu est un mélange racémique, sans activité optique: mélange des deux énantiomères en quantité égale.
Qté de matière de D (C8H18O): 3,5 / (8*12+18+16) = 26,9 mmol
Qté de D théoriquement attebdue : 52 mmol
rendement : 26,9 / 52 = 0,52 (52 %).
l'alcool secondaire d s'oxyde en cétone.
2 fois {MnO4- + 8H+ + 5e- = Mn2+ + 4H2O }réduction
5 fois { C8H18O = C8H16O+ 2H+ + 2e- } oxydation
2 MnO4- + 5 C8H18O +6H+ -->2Mn2+ + 5C8H16O + 8H2O
retour - menu