. .
|
|
|
|
dipole RL
L'intensité passe d'une valeur égale à 10% de sa valeur maximale à une valeur égale à 90% de sa valeur maximale, sur une durée Dt=2,2 t (t=L/R), constante de temps du circuit
A l'aide du graphique en déduire t.
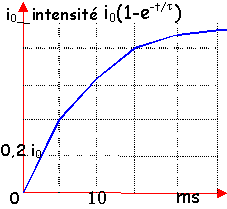
A partir des 2 intersections avec la courbe , tracer 2 verticales.
déterminer sur le graphe la distance séparant ces 2 verticales; tenir compte de l'échelle; cet intervalle de temps vaut 2,2 t
t
voisin de 10 ms
ou bien à
t=t
l'intensité vaut 63% de sa valeur
finale.
quelques solutions
- Un litre d'une solution acqueuse de chlorure de sodium contient 0,02 mol de soluté. Calculer la quantité de soluté contenu dans 50 mL de cette solution.
- Un litre d'une solution acqueuse de CuSO4 contient 0,10 mol de CuSO4 ( le soluté).Calculer la quantité de matière et la masse de soluté présent dans 100 mL de cette solution.
- Calculer le volume de cette solution qui ne contiendrait que 1 g de soluté.
- Merci de m'indiquer les formules ci-dessous :
-nitrate de calcium
-sulfate d'amonium
-carbonate de sodium
-chlorure de magnésium
0,02*0,05=10-3
mol
même calcul : 0,1*0,1=
0,01
mol de
CuSO4.
masse de soluté (g) =Qté de matière (mol) fois masse molaire CuSO4.(gmol-1)
masse molaire :63,5+32+4*16=159,5 gmol-1
masse : 0,01*159,5=1,59 g
|
|
|
|
|
|
|
|
|
le solide doit être électriquement neutre
sulfate de cuivre pentahydraté
Quelle masse de CuSO4,5H2O faut-il utiliser pour préparer 100 mL de solution de sulfate de cuivre de concentration molaire 0,1 mol/L?
masse atomique molaire en g mol-1: Cu=63,5 ; S=32 ; O=16 ; H=1
..
Qté de matiére (mol) de sulfate de cuivre dans la solution
volume (litre) fois concentration (mol L-1)=0,1*0,1= 0,01 mol
masse (g)=masse molaire gmol-1* qté de matière (mol)=249,5*0,01=2,49 g
chlorure de sodium
Le sérum physiologique est une solution de chlorure de sodium. Une préparation pour une perfusion contient 0,9% en masse de NaCl.
masse atomique molaire en g mol-1: Na=23 ; Cl=35,5
- Déterminer la concentration massique de cette solution en prenant pour la masse volumique de la solution: r = 1,0 g/cm3
- En déduire sa concentration molaire.
concentration massique ou titre = 9 g L-1.
concentration molaire mol L-1 = Qté matiére (mol)/ volume (L)
Qté de matière (mol) = masse (g) / masse molaire (g mol-1)
9/(23+35,5)= 0,154 mol L-1
chlorure de baryum
On a dissout 31,2g de chlorure de baryum dans 100 g d'eau. La densité de la solution est 1,24 .
Masse molaire atomique en g.mol-1:Cl=35.5 ;Ba=137
- Quelle est la concentration massique de cette solution?
- Quelle est la concentration des espèces ioniques dans la solution?
..
pourcentage massique en chlorure de baryum 31,2/131,2*100= 28,78%
densité=1,24 signifie que 1 L de solution a une masse de 1240 g
et contient en masse :
1240*0,2878=
294,9 g L-1.
masse molaire du chlorure de
baryum
137+2*35,5=
208 g
mol-1
concentration molaire (mol L-1) = concentration massique (g L-1) / masse molaire (g mol-1)
294,9/208=1,41 molL-1
BaCl2 donne Ba2+ + 2 Cl-
[Ba2+]=1,4mol.L-1 et [Cl-]=2,8mol.L-1.
combustion de l'éthane
J'ai l'équation bilan de la combustion de l'éthane dans le dioxygène pur:
C2 H6 O + 3O2 donne 2CO2 + 3H2O
IL se forme 4,5 g d'eau,calculer les volumes d'éthane et de dioxygène qui ont réagi. Conditions:20 degrés ; volume molaire : 24 L mol-1. O=16 ; H=1 ; C=12 g mol-1.
.
4,5/18= 0,25 mol
chlorure d'hydrogène HCl
On dissout 10-2 mol de chlorure d'hydrogène dans un litre d'eau à 25°C
- Comment mettre en évidence expérimentelement les ions mojoritaires présents dans la solution obtenue.
- le pH de la solution est de 2.
En déduire les concentrations des espèces
chimiques présentes dans la solution.
Et il faut exploiter les résultats pour montrer que la réaction entre chlorure d'hydrogène et l'eau est totale.
.
les ions chlorures donnent en présence d'ion argent Ag+ (AgNO3) un solide blanc de chlorure d'argent AgCl
pH=2 donc [H3O+ ]= 10-2 mol L-1.
produit ionique de l'eau [H3O+ ]*[OH- ]=10-14 à 25°C
donc [OH- ]= 10-12 mol L-1.
La solution reste électriquement neutre
[H3O+ ] =[Cl- ] + [OH- ] donc [Cl- ] proche 10-2 mol L-1.
conservation de l'élément chlore
[HCl] début=0,01=[Cl- ]+[HCl] fin
or [H3O+ ] =0,01=[Cl- ] + [OH- ]
donc [HCl] fin= [OH- ]= 10-12 mol L-1.
La solution ne contient pratiquement plus de molécules HCl ; la réaction avec l'eau est totale.
L'hydroxyde de calcium Ca(OH)2
- L'hydroxyde de calcium
Ca(OH)2 est soluble dans l'eau à raison
de 1,9 g.L-1 à 25°C.
On obtient une solution saturée. Ca=40 ; O=16 ; H=1 g mol-1.
- Quelle est la concentration de l'hydroxyde de calcium dissout, de l'ion Ca2+, et OH-
- Le pH d'une telle solution étant de 12,7 montrer que l'hydoxyde de calcium est entièrement dissociée en solution aqueuse.
..
1,9/(40+2+36)= 0,0256 mol d 'hydroxyde de calcium
Ca(OH)2 donne Ca2+ + 2 OH-
[Ca2+]=0,0256
mol L-1 ;
[OH-
]=2*0,0256=0,051
mol L-1 ;
pH=12,7 donc
[H3O+ ]=
2 10-13 mol
L-1.
produit ionique de l'eau [H3O+ ]*[OH- ]=10-14 à 25°C
donc [OH- ]= 5 10-2 mol L-1.
La solution reste électriquement neutre
[H3O+ ] +2[Ca2+ ] = [OH- ] donc [Ca2+ ] proche 2,5 10-2 mol L-1.
conservation de l'élément calcium
[Ca(OH)2] début=0,0256=[Ca2+ ]+[Ca(OH)2] fin
or [OH- ]=0,05= 2[Ca2+ ] + [H3O+ ]
donc [Ca(OH)2] fin = 0,5 *[H3O+ ]= 10-13 mol L-1.
La solution ne contient pratiquement plus de Ca(OH)2; la réaction avec l'eau est totale.
cinétique 2I- + S2O82- donnent I2 + 2 SO42-
L'action lente des ions peroxodisulfate(S2O82-) sur les ions iodures (I-), en présence ou non d'ions Fer(III), s'effectue selon l'équation bilan suivante :
Pour étudier la cinétique de cette réaction (1) la concentration du diiode I2 est déterminée grâce à 1 dosage rapide par une solution de thiosulfate (S2O32-) de concentration C1= 0,01 mol.L-1 selon l'équation suivante :
- La solution titrée d'ions S2O32- est obtenue à partir de cristaux hydratés de thiosulfate de sodium dont la formule chimique peut s'écrire Na2S2O3,5H2O. Déterminer la masse de cristaux à peser pour obtenir 250 mL d'une solution mère de concentration C2= 0,50 mol.L-1
- Exposez brièvement la technique expérimentale mise en oeuvre (verrerie de précision et capacités utilisées, méthode...) pour préparer à partir de la solution mère, 500ml de thiosulfate de sodium de concentration C1= 1.0 *10-2 mol.L-1
- Un volume V0 de mélange réactionnel de la réaction (1) est dosé par un volume V1 de soltuion de thiosulfate de concentration C1 pour obtenir l'équivalence d'oxydoréduction lors de la réaction (2).Etablir la relation : [I2] = (C1V1)/ (2VO) donnant la concentration de diiode libérée. Na=23 ;S =32 ; O =16 ; H = 1 g.mol-1
masse molaire: 23*2+64+48+5*18=248 gmol-1.
Qté de matière (mol)=concentration(mol L-1)*volume(L)=0,5*0,25=0,125 mol
masse des cristaux=
Qté de matière
(mol)*masse
molairegmol-1=0,125*248=
31g
prélever un volume V de
la solution de départ à la
pipette
placer dans fiole jaugée de 500 mL
complétée à l'eau distilée
volume pipette(L) *[solution départ](mol L-1)=volume fiole(L) *[solution finale](mol L-1)
V=0,5*0,01/0,5=10
mL
Qté de matière
(mol)
diiode: V0[I2]
thiosulfate V1C1
d'après l'équation bilan (2) : V1C1= 2*V0[I2]
masse d'un litre de vinaigre
Un vinaigre est dilué 10 fois. L'equivalence du dosage de 10 mL de ce vinaigre dilué par de la soude à 0,1 molL-1 s'est produite pour un volume de un centilitre soit 10 mL.
Calculer la masse d'un litre de vinaigre. on rappelle que la densite de l'acide acétique constituant principal du vinaigre est d=1,05.
..
Ca=0,1 molL-1 solution diluée
vinaigre
C= 1 mol L-1 ou 60 g L-1.
masse de 1 L de vinaigre =
masse d'acide acétique + masse d'eau
60 g de vinaigre occupe un volume de :60/1,05=57,14 mL
soit 1000-57,14= 942,8 mL d'eau ou 942,8 g
masse de 1 L vinaigre= 60+942,8 = 1002,8 g