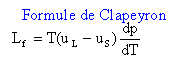|
Capes interne 91 exercice suivant En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
| .
. |
|
|
|
|
Le diagramme des phases de l'eau est représenté en coordonnées P et T ci-dessous. 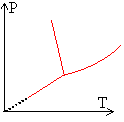
|
|
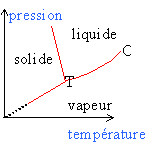
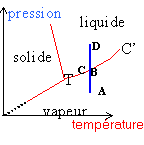
L'eau existe sous 3 états: solide, liquide et vapeur. Le point triple T: pour une pression et une température données les 3 phases cohexistent. Chaque courbe correspond à l'équilibre sous deux phases: - la vaporisation est le passage liquide vapeur, l'inverse est appelé liquéfaction - la fusion est la transition solide liquide, le passage inverse est la solidification. -la sublimation est la transition solide vapeur, la transition inverse est la condensation . Le point critique C: il limite la courbe de vaporisation. Au delà de C le corps pur est dans un état appelé fluide.
A cet équilibre correspond à une pression p
appelé pression de vapeur saturante qui ne
dépend que de la
température.
Lf : chaleur latente de fusion, grandeur positive. en conséquence le volume massique uL de l'eau est supérieur à celui uS de la glace.(la glace flotte sur l'eau). L'eau est un cas particulier: pour la majorité des
cas c'est l'inverse avec dp/dT
positive.
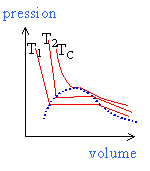
La courbe en pointillés est
appelée courbe de saturation, lle se compose de 2
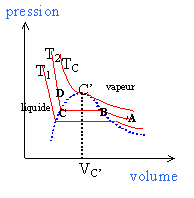
parties: -courbe de rosée pour V>VC'. Au point critique C' les deux branches se raccordent.
En B apparaît la première goutte de liquide. de B à C la transformation est isobare en C la dernière bulle de vapeur disparaît.
les points B et C sont confondus.
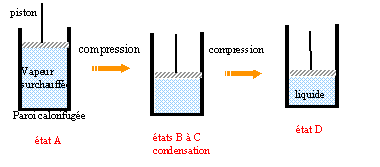
à la surface de contact liquide, l'évaporation est une vaporisation: l'atmosphère étant illimitée, la pression de vapeur saturante n'est pas atteinte et le liquide s'évapore lentement et entièrement. L'ébullition est un
phénomène global de formation des bulles dans
tout le liquide. Transition liquide vapeur en
présence d'air.
pv = nRT avec n = masse (g) / 18 m = 18pv / (RT) = 1610*1*18 /( 8,31* 293) m= 11,9 g.
retour - menu |