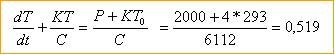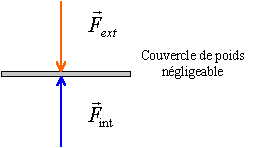|
|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||
|
durée du chauffage |
le récipient : D=28 cm; h=16 cm ; m=4,2 kg ; c=460J K-1 kg-1. puissance du système de chauffe : 2 kW
corrigé |
||
|
|
C=1*4180+4,2*460 = 6112 J K-1. puis multiplier par l'écart de température 100-20 =80° pour obtenir l'énergie : 488 960 J diviser par la puissance (en watt) pour obtenir la durée du chauffage : 488 960 / 2000 = 244 s =4 min 4 s
Bilan énergétique entre les instants t et t+ dt, la température passe de T à T+dT dQ= C dT + K(T-T0) dt La puissance fournie par le système sert à élever la température et à compenser les pertes. P = dQ/dt = CdT/dt + K(T-T0)
Tfinale =293 K ; d'où t=226 s = 4 min 26 s. volume du récipient : pr²h= 9,85 L volume de la vapeur 9,85- volume de l'eau =8,85 L masse de vapeur : 8,85 10-3 * 0,6 = 5,3 g chaleur nécessaire au changement d'état : 5,310-3 *2 257 =12 kJ quantité négligeable devant 489 kJ.
|
||
|
étude du régime permanent |
La pression à l'intérieur du récipient a atteint la valeur de régime soit 1,69 bar et la tempèrature est de 115 °C. L'air a été entierement chassé, la vapeur d'eau est en équilibre avec le liquide. On continue à chauffer et la soupape se met en rotation : un jet est éjecté. Dans ces conditions (vapeur 0,965 kgm-3. chaleur latente de vaporisation 2 215 kJ kg-1)
corrigé |
||
|
|
masse de vapeur : 8,85 10-3 *0,965 = 8,54 g La puissance fournie sert à évaporer l'eau et à compenser les pertes. pertes par convection à 115 °c : 4(115-20)=380 W puissance utile à évaporer l'eau : 2000-380=1620 W 1620 = 2,215 106 * débit massique (kg s-1) débit = 7,31 10-4 kg s-1=0,731 g s-1. Le jet est une détente brutale sans échange de chaleur avec l'extérieur (adiabatique). La vapeur se refroidit brutalement et le jet est formé de fines gouttes d'eau à la température de 100°C sous 1,013 bar.
|
||
|
arrêt du chauffage |
On arrête le chauffage. La soupape se referme dés que la pression est inférieure à 1,69 bar. On laisse le récipient et son contenu revenir à la température ambiante.( à 20 °C la pression interne est 0,0234 bar).
corrigé |
||
|
|
à l'équilibre les deux forces se neutralisent . Pour rompre cet équilibre il faut exercer la force : Force = (Pext-Pint) * surface du couvercle pression en pascal et surface en m² F = (1,013-0,0234)105*3,14*0.14²= 6100 N il vaut mieux enlever la soupape (sa section étant faible c'est facile) et laisser les pressions s'égaliser avant de retirer le couvercle. retour - menu |