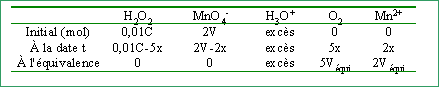|
|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||
|
acide base |
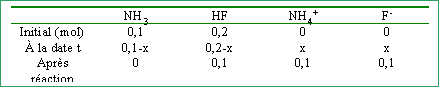
On place dans 1 L d'eau pure 0,1 mol d'ammoniac NH3 et 0,2 mol de d'acide fluorhydrique HF. pKa NH4+ /NH3 =9,2 ; pKa HF/F- = 3,2
corrigé |
||
|
|

La constante Kr étant élevée , la réaction est totale. tableau d'avancement de la réaction :
l'ammoniac est le réactif limitant. L'avancement est maximal lorsque l'un des réactifs a diparu : x maxi =0,1 mol
concentrations finales et pH : [NH4+] = [F-]= 0,1 mol L-1. [HF] = 0,1 mol L-1. la solution contient l'acide faible HF et sa base conjuguée F- en quantités égales. C'est une solution tampon et le pH est égal au pKa du couple soit 3,2. |
||
|
acides et métaux |
On ajoute m = 1 g de fer à 250 mL d'acide sulfurique tel que la concentration initiale en ion hydronium soit 0,2 mol L-1. ( [sulfate]=0,1 mol L-1)
corrigé |
||
|
|
quantités de matière initiale des réactifs:
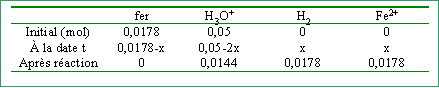
réactif limitant, celui qui disparaît le premier soit le fer avancement maximal : xmaxi = 0,0178 mol concentrations finales et pH :
[H3O+] + 2 [Fe2+] = 2 [SO42-] 0,0576 + 2*0,0712 = 0,2 est vérifiée
|
||
|
eau oxygénée et ion permanganate |
On dose 10 mL d'une solution d'eau oxygénée de concentration C par une solution de permanganate de potassium à 2 mol L-1 en présence de 1 mL d'acide sulfurique (en excès).
Volume molaire =24 L mol-1. corrigé |
||
|
|
2 fois {MnO4- + 8H+ + 5e- --> Mn2+ + 4 H2O }réduction 5 fois { H2O2 --> O2 + 2 H+ + 2e- } oxydation 2 MnO4- + 6 H+ + 5 H2O2 --> 2 Mn2+ + 5 O2 + 8 H2O quantité de matière initiale d'eau oxygénée : 0,01 C mol quantité de matière d'ion permanganate ajouté à la date t :x=2V (V en litre)
A l'équivalence les 2 réactifs sont consommés : 0,01C-5x=0 et 2Véqui=2x--> x=0,02 mol et C=10 mol L-1. pour V=10 mL soit la moitié du volume équivalent --> x=0,5 xmaxi=0,01 mol, l'ion permanganate est le réactif limitant. [H2O2] = (0,1-0,05 ) / (10+10+1)10-3= 2,38 mol L-1. [Mn2+]= 0,02/21 10-3 = 0,95 mol L-1. volume O2 = 0,05*24 = 1,2 L pour V = 40 mL soit le double du volume équivalent --> x= xmaxi= 0,02 mol, l'eau oxygénée est le réactif limitant. [MnO4-] = (0,02*2 ) / (10+40+1)10-3= 0,784 mol L-1. [Mn2+] = 0,04/51 10-3 = 0,784 mol L-1. volume O2 = 0,1*24 = 2,4 L
retour - menu |