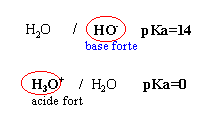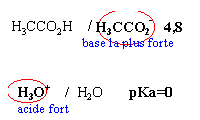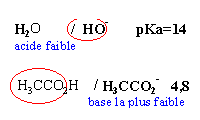|
exercice
1
|
réactions
prépondérantes - solution
tampon
|
|
Dans 1 litre d'eau à 25 °C on
introduit, sans modifications de volume,
- 0,1 mol de chlorure d'hydrogène
- 0,05 mol de soude
- 0,1 mol d'acétate de sodium
pKa du couple ac
éthanoique / ion éthanoate
4,8
vrai ou
faux
- la première
réaction pépondérante qui a
lieu s'écrit H3O+
+OH- donne 2
H2O
- la seconde
réactionprépondérante
s'écrit H3CCOO-
+H3O+ donne
H3CCOOH+ H2O
cette
réaction peut être
considérée comme
totale.
- la réaction
entre les ions éthanoate et l'eau est
pratiquement inexistante.
- Le pH de la solution
est voisin de 4,8
|
|
|
corrigé
|
|
|
Les 2 premières propositions sont
vraies ; l'acide le
plus fort est mis en présence de la base la
plus forte et la différence des pKa est
supérieure à 3
vrai
l'ion éthanoate
est la base la plus faible et l'eau l'acide le plus
faible KR=10-9,2.
vrai
0,05 mol d'ion
HO- réagit avc 0,05 mol
H3O+ issu de HCl
0,05 mol d'ion
éthanoate réagit avc 0,05 mol
H3O+ issu de HCl donnant
0,05 mol
H3CCO2H
il
reste 0,05
mol d'ion
H3CCO2-
c'est une
solution tampon de pH=pKa=4,8
(Qté de
matière d'acide faible =Qté de
matière base
conjuguée)
|
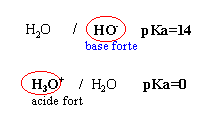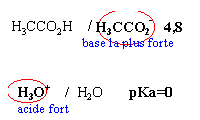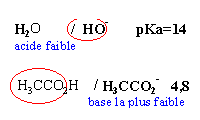
|
|
exercice
2
|
phosphate
d'ammonium
|
|
Un litre de solution d'engrais pour plante est
préparé en dissolvant 0,1 mol de
phosphate d'ammonium solide
(NH4)3PO4 dans la
quantité d'eau nécessaire. La
consatnte de réaction entre les ion ammonium
et phosphate est:1580 ; 3,2 ; 1,72
; 1,58 10-3
pKa(NH4+/NH3
)=9,2 ;
pKa(HPO42-/PO43-)=12,4
|
|
|
corrigé
|
|
|
|
|
Qté de matière d'ion
hydroxyde (mol)
|
0.1*0,05
|
5 10-3
|
|
Qté de matière
d'acide éthanoique (mol)
|
0,1*0,1
|
0,01
|
|
arrèt
à la demi équivalence du
dosage acide faible base
forte
|
pH=pKa=4,75
|
|
|
|
|
|
exercice
3
|
acide
lactique
|
|
L'acidité d'un lait
se mesure en degré Dornic . Un degré
Dornic correspond à 0,1 g d'acide lactique
par litre de lait. Un lait frais a un degré
inférieur à 18 °D.
Les bactéries
transforment le lactose en acide
lactique.
- La molécule d'acide lactique
H3C-CHOH-COOH
(pKa=3,9) est-elle
chirale ? Quelle est sa base conjuguée
?
- On dose 50 mL de lait
par une solution de soude à 0,1 mol
L-1 en présence de
phénolphtaléine dont la zone de
virage est [8 ; 9]. Ecrire
l'équation bilan. Calculer le Kr.
Conclure.
- Justifier le choix de
cet indicateur.
- On verse 11 mL de
soude pour atteindre l'équivalence acide
base. En déduire le degré du
lait.
|
|
|
|
corrigé
|
|
|
|
|
le
carbone porteur du groupe alcool
CHOH
, lié à 4 autres groupes d'atomes
différents est un carbone asymétrique
donc la molécule est chirale.
La
base conjuguée est :
H3C-CHOH-COO-.
ion
2-hydroxypropanoate
H3C-CHOH-COOH +
HO-
donnent
H3C-CHOH-COO-
+ H2O
couples
acide base mis en jeu l'acide
lactique est noté AH
|
H2O
/
HO-
pka=14
|
L'acide le plus fort est mis en
présence de la base la plus forte
et la différence des pKa est 10,1.
La réaction
sera
totale
Kr=1010,1
|
|
AH
/
A-
pka=3,9
|
A l'équivalence acide base la solution
contient une base , l'ion
H3C-CHOH-COO-
donc
le milieu est basique pH>7. La zone de virage de
l'indicateur doit contenir le pH à
l'équivalence. Le choix est
correct.
CaVa=
CbVb
à
l'èquivalence
11
10-3 *0,1 = 50 10-3 * Ca
....0,022
mol L-1 d'acide lactique
soit
en masse : masse molaire ac lactique
*0,022=90*0,022 = 1,98
g dans 1 litre
19,8
°D lait pas frais.
|
|
|
|
exercice
4
|
acide
salicylique et ammoniac
|
|
L'acide salicylique est noté AcH. Dans
100 mL d'une solution d'acide salicylique à
0,2 molL-1, on ajoute sans dilution 5
10-3 mol d'ammoniac NH3.
pKa des couples AcH/Ac- : 3 ;
NH4+ /NH3 :
9,2
- Ecrire l'équation bilan et calculer
la constante Kr; conclure.
- Calculer [AcH]fin ,
[Ac-]fin et le pH
final.
|
|
corrigé
|
NH4+
/NH3
: 9,2
AcH/Ac-
: 3
|
|
L'acide le plus fort
(AcH)
réagit naturellement avec la base la plus
forte (NH3).
Les pka étant différent de 6,2
unités la constante Kr est grande
Kr=106,2 =
1,58 106. La réaction est
totale.
AcH
+ NH3
--->
Ac- + NH4+
|
Qté mat (mol)
|
NH3
|
AcH
|
NH4+
|
Ac-
|
|
départ
|
5 10-3
|
2 10-2
|
0
|
0
|
|
réaction
|
-5 10-3
|
-5 10-3
|
+5 10-3
|
+5 10-3
|
|
bilan
|
0
|
1,5 10-2
|
+5 10-3
|
+5 10-3
|
|
molL-1
|
|
0,15
|
0,05
|
0,05
|
la solution finale contient le couple
AcH/Ac-
pH = pKa + log
[Ac-]/{AcH] = 3+
log(0,05/0,15) = 3-0,48 = 2,52
retour
- menu
|
|