résumé
de cours
sujets
2000,
01
, 02,
03,
04,
05![]()
fiche
bac
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
..
..
| .
. |
acide : un acide est une espèce chimique susceptible de céder un proton H+.
Une base est une espèce chimique capable de capter un proton H+.
Un couple acide/base noté AH / A- est l'ensemble d'un acide et d'une base tels que :
A 25°C : 
exemples :
l'eau et l'ion hydrogénocarbonate se comportent soit
comme un acide soit comme une base : Ils sont
amphotères.
Une réaction acido-basique est une transformation mettant en jeu deux couples acido-basiques, acide1/base1 et acide2/base2, qui échangent un proton H+.
exemple :CH3-COOH + HO- = CH3-COO- + H2O
Un indicateur coloré acido-basique contient un couple acide base dont la forme acide a une teinte différente de la forme basique.
Il permet, lors d'un dosage acide base, de repèrer l'équivalence.
L'hélianthine est un indicateur coloré correspondant au couple acide/base noté HIc(aq)/Ic-(aq) où Ic représente un groupe d'atome qui n'est pas explicité et H l'atome d'hydorgène. Le rapport entre la concentration de la forme acide et celle de la forme basique en fonction du pH est donné ci-dessous : ( à pH 1,5 : 100 ; à pH 2,5 : 10 ; à pH 3,5 : 1 : à pH 4,5 : 0,1 )
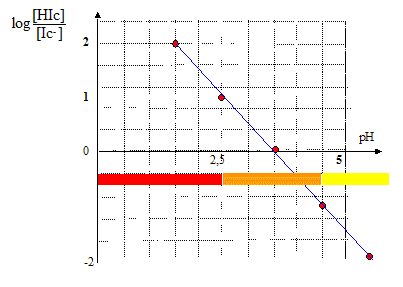 |
Lorque [Ic-] >10[HIc] ou encore pH>4,5, la solution est jaune, c'est la couleur de la forme basique. On appelle zone de virage l'intervalle dans lequel la teinte change ; dans ce cas le pH est compris entre : [2,5 ; 4,5] |
Un réducteur est une espèce susceptible de donner un ou plusieurs électron(s).
par exemple: Zn = Zn2+ + 2e-. oxydation du zinc
Un oxydant est une espèce susceptible de capter un ou plusieurs électron(s).
Un couple oxydant réducteur noté ox / red est l'ensemble d'un réducteur et d'un oxydant tels que :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- La conservation de la charge électrique est assurée par les électrons.
- La conservation des éléments nécessite, le cas échéant, l'intervention de l'oxygène (on le trouve dans l'eau pour les solutions aqueuses) et/ou des ions H+ ou H3O+(pour certaines réactions qui ont lieu en milieu acide).
Une réaction d'oxydoréduction met en jeu deux couple rédox. Elle consiste en un transfère d'un ou plusieurs électron(s) du réducteur de l'un des couples à l'oxydant de l'autre couple.
Tous les électrons cédés par le réducteur du premier couple sont captés par l'oxydant du deuxième couple. Par conséquent il n'apparaît aucun électron dans l'équation de la réaction.
5 fois{ Fe2+ = Fe3+ +e- } oxydation de l'ion fer II
MnO4- + 8H+ + 5 Fe2+ = 5 Fe3+ + Mn2+ + 4H2O oxydoréduction
Doser ou titrer une espèce chimique en solution consiste à déterminer la concentration molaire de cette espèce dans la solution.
L'équivalence E est atteinte lorsque les réactifs (espèce titrée et espèce titrante) ont été mélangés dans les proportions stoechiométriques. A l'équivalence, il y a changement de l'espèce limitante. Avant l'équivalence, l'espèce limitante est l'espèce titrante. Après l'équivalence, l'espèce limitante est l'espèce titrée.
Le repérage de l'équivalence se fait grace au changement de couleur de la solution contenue dans le bécher. (emploi éventuel d'un indicateur coloré)
ou bien par suivi de la conductivité ou de la conductance de la solution