résumé
de cours
sujets
2000,
01
, 02,
03,
04,
05![]()
fiche
bac
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
..
..
| .
. |
La chimie organique est la chimie des composés du carbone d'origine naturelle ou produits par synthèse. Ces composés présentent un nombre très limité d'éléments autres que le carbone. On trouve en particulier les éléments hydrogène, oxygène, azote, phosphore soufre et les halogènes.
La règle de l'octet permet de prévoir que l'atome de carbone engagera 4 liaisons covalentes (4 doublets liants). Les quatre liaisons de l'atome de carbone peuvent être distribuées de trois façons différentes dans l'espace.
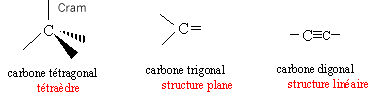
On appelle chaîne carbonée ou squelette carboné l'enchaînement des atomes de carbone constituant une molécule organique.
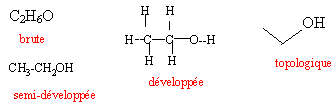
La formule brute du type CxHyOz (il peut y avoir d'autres éléments), elle nous renseigne sur la nature et le nombre des atomes constitutifs.
La formule développée plane elle fait apparaître tous les atomes dans le même plan et toutes les liaisons entre ces atomes. Les angles entre les liaisons sont de 90°, exceptionnellement de 120° pour des raisons de clarté, ce qui ne représente pas la réalité géométrique de la molécule.
La formule semi-développée (plane) elle dérive de la précédente par suppression des liaisons mettant en jeu l'hydrogène
La formule topologique la chaîne carbonée est représentée par une ligne brisée. Chaque extrémité de segment représente un atome de carbone portant autant d'atomes d'hydrogène qu'il est nécessaire pour satisfaire à la règle de l'octet. Les atomes autres que C sont représentés de manière explicite ainsi que les atomes d'hydrogène qu'ils portent.
Deux corps isomères sont des composés qui ont la même formule brute mais des structures différentes. Des isomères de constitution ont la même formule brute mais des formules développées planes (ou semi-développées) différentes.

Isomérie Z–E. Cette isomérie concerne certaines molécules de dérivés éthyléniques, c'est-à-dire des molécules présentant non seulement au moins une double liaison entre deux atomes de carbone mais aussi une structure du type: AHC=CHB (les groupes A et B pouvant éventuellement être identiques).
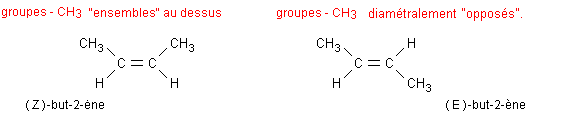
Un groupe caractéristique est un groupe d'atomes qui confère (donne) des propriétés spécifiques aux molécules qui le possèdent. On dit que ces molécules forment une famille chimique.
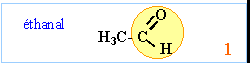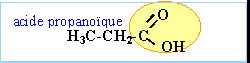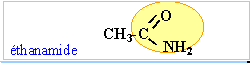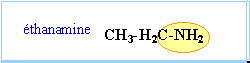
composés halogénés:les molécules présentant un groupe halogéno font partie de la famille des composés halogénés. Si R représente la chaîne carbonée, ces composés pourront être notés très généralement R—X
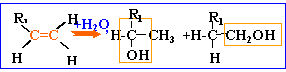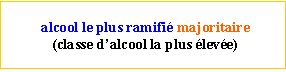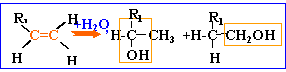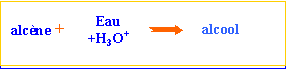
alcools: les molécules de cette famille présentent toutes un groupe hydroxyle fixé sur une chaîne carbonée. On pourra les noter d'une façon générale R—OH.
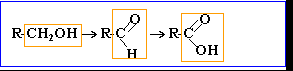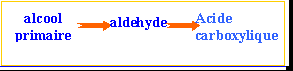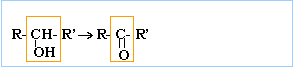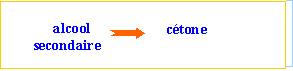
aldéhydes : le groupe carbonyle est situé en bout de chaîne. On pourra les noter d'une façon générale R—CHO
cétones Le groupe carbonyle est situé dans la chaîne. On pourra les noter d'une façon générale R1—CO—R2.
acides carboxyliques : les molécules de cette famille présentent toutes le groupe carboxyle en bout de chaîne. On pourra les noter R—COOH ou plus simplement R—CO2H
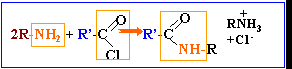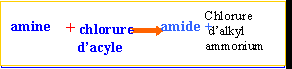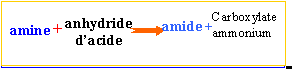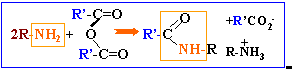
amines : les molécules de cette famille présentent toutes un groupe amino fixé sur une chaîne carbonée. On pourra les noter d'une façon générale R—NH2.
Une amine se caractérise par le caractère basique de sa solution aqueuse. Elle fait partie du couple acide/base
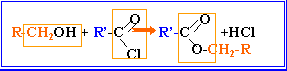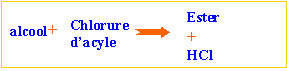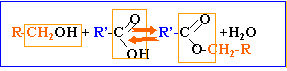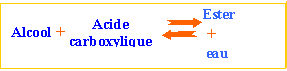
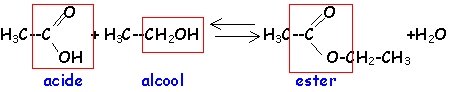
ester : l'action d'un acide carboxylique sur un alcool donne un ester. La réaction est limitée par l'hydrolyse de l'ester qui se produit simultanément. On aboutit à un état d'équilibre dans lequel ces deux réactions se produisent à la même vitesse.
Estérification et hydrolyse sont lentes, catalysée par les ion oxonium.
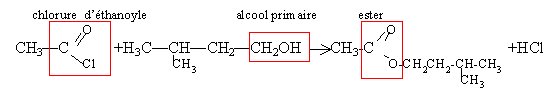
l'action d'un chlorure d'acyle sur un alcool donne un ester. La réaction est totale.
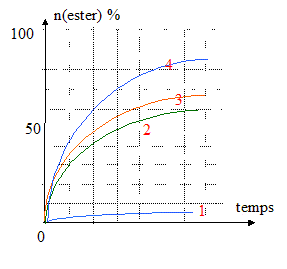
Réaction d'un mélange
équimolaire d'acide carboxylique et
d'alcool : le rendement à
l'équilibre est de 67% pour un alcool
primaire (3) , de 60%
pour un alcool secondaire
(2) et de 5% pour un
alcool tertiaire
(1); La quantité de matière initiale
d'un réactif est double de celle de
l'autre : le rendement à
l'équilibre est de 84% dans le cas d'un
alcool primaire
(4).
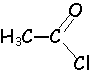
anhydride d'acide, chlorure d'acyle, plus réactifs
que les acides.
![]()
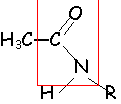
en présence d'eau il donne l'acide de départ
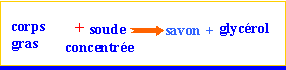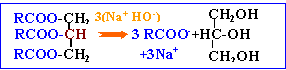
La réaction de saponification ( ester + soude) est lente mais totale.
elle conduit à un alcool et à un carboxylate de sodium
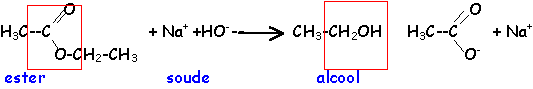
Test commun aux aldéhydes et aux cétones.
Les composés carbonylés (aldéhydes et cétones) se caractérisent à l'aide de la 2,4-dinitrophénylhydrazine (DNPH) avec laquelle ils donnent un précipité jaune-orangé de 2,4-dinitrophénylhydrazone.
Tests spécifiques des aldéhydes.
Liqueur de Fehling: Le chauffage modéré d'un mélange contenant de la liqueur de Fehling et un aldéhyde conduit à un précipité rouge brique (constitué d'oxyde de cuivre (I) Cu2O).
Réactif de Tollens (solution de nitrate d'argent ammoniacal): Le chauffage modéré (50°C à 60°C au bain marie) d'un mélange de réactif de Tollens et d''aldéhyde dans une verrerie très propre conduit à la formation d'un miroir d'argent sur les parois de la verrerie.
Réactif de Schiff (fuschine décolorée par le dioxyde de soufre): A froid et en milieu non basique, en présence d'un aldéhyde le réactif de Schiff prend une teinte rose- violacée.