L'azote
ammoniacal est souvent le principal indicateur chimique de pollution
directe d'une
eau de rivière à la suite d'un rejet polluant. C'est en détectant la
présence d'azote
ammoniacal que l'on peut situer le long d'un cours d'eau les rejets
d'eaux usées dus, entre
autres, aux déjections humaines. Dans les eaux, la présence d'azote
ammoniacal ne doit
pas dépasser 0,10 mg L
-1
. L'objectif de cet exercice est de déterminer si un échantillon d'eau
de rivière est pollué par
l'azote ammoniacal.
Couples acido-basiques : ammonium / ammoniaque NH
4 +(aq) / NH
3 (aq) pKa1 = 9,22.
eau / ion hydroxyde H
20 (l) / HO
- (aq)
pKa2 = 14,0
- Conductivités molaires ioniques
l0(en mS m
2.mol
-1)
NH
4+aq : 7,35 ; Na
+aq : 5,01 ; HO
-aq : 19,8.
Dans l'eau, en fonction du pH et de la température, l'azote ammoniacal se rencontre sous
deux formes :
l'ion ammonium et l'ammoniac aqueux NH
3(aq).
On étudie un échantillon d'eau prélevé à 20 °C dans une rivière. Son pH est égal à 7,2.
Q1 - Définir un acide selon Bronsted.
Un acide est une espèce, ion ou molécule, susceptible de céder un proton H
+.
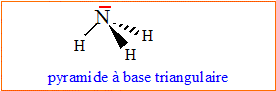
Q2- Etablir le schéma de Lewis de l'ammoniac.
 Q3-
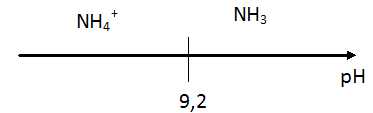
Q3- Représenter le diagramme de prédominance du couple ion ammonium /
ammoniaque.
 Q4-
Q4- Identifier, en justifiant, l'espèce ammoniacale prédominante dans l'échantillon
prélevé.
A pH = 7,2, inférieur à 9,2, l'espèce NH
4+ prédomine.
Dans la suite de l'exercice, seul l'ion ammonium sera pris en compte dans l'analyse de
l'échantillon prélevé.
On réalise un titrage par suivi conductimétrique d'un volume V = 200,0 mL de l'échantillon
prélevé.
Pour le titrage, on prépare 50,0 mL d'une solution titrante S de concentration en quantité de
matière c
1 = 3,50 ×10
-4 mol L
-1 en hydroxyde de sodium (Na
+(aq), HO
- (aq)) en diluant dix
fois une solution mère S
0 disponible au laboratoire.
Q5- Choisir, en justifiant, la verrerie utilisée pour mettre en œuvre la dilution de la
solution S
0 parmi la liste de matériel à disposition :
- un bécher
- un erlenmeyer de 50 mL
- une fiole jaugée de 50,0 mL
- des pipettes jaugées : 5,0 mL; 10,0 mL ; 50,0 mL
- des éprouvettes graduées de 5 mL et 10 mL
Fiole jaugée de 50,0 mL. Facteur de dilution F = 10 ; pipette jaugée de 50 /10 = 5,0 mL.
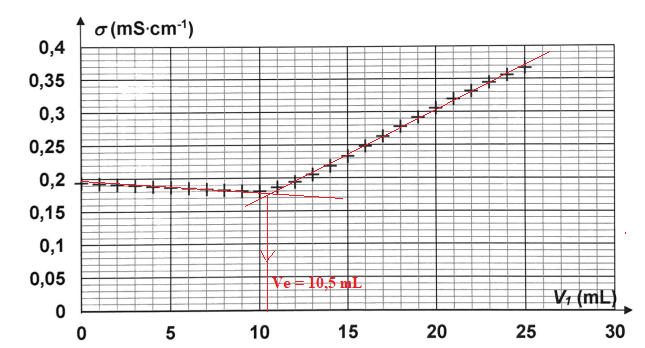
Après chaque ajout de solution titrante S, on mesure la conductivité
s de la solution. La
figure ci-après donne l'évolution de la conductivité
s en fonction du volume Vi de solution
titrante S.
L'équation de la réaction support du titrage est la suivante :
NH
4+ (aq) + HO
- (aq) --> NH
3(aq) + H
20(l)
Q6- Justifier sans calcul l'évolution de la courbe de la figure avant et après
l'équivalence.
Avant l'équivalence HO
- est en défaut : du point de vue de
la conductivité tout se passe comme si on remplaçait des ion ammonium
par des ion sodium de conductivité molaire ionique moindre : la
conductivité de la solution diminue.
Après l'équivalence : HO
- en excès. On ajoute des ions hydroxyde et sodium à la solution. La conductivité croît.
Q7 - Déterminer la valeur du volume Ve d'hydroxyde de sodium versé à l'équivalence
en explicitant la méthode utilisée.
Ve = 10,5 mL.
Q8- Indiquer si l'échantillon d'eau de rivière est pollué par l'azote ammoniacal.
Quantité de matière d'ion hydroxyde à l'équivalence : c
1 Ve = 3,50 10
-4 x 10,5 =3,675 10
-3 mmol.
Quantité de matière d'ion ammonium : V [NH
4+]=200,0
[NH4+] =3,675 10-3 .
[NH4+] =3,675 10-3 / 200 =1,8 10-5 mol / L.
M(NH4+) = 18 g/mol.
1,8 10-5 x18 =3,3 10-4 g / L = 0,33 mg / L.
Valeur supérieure à 0,10 mg / L : l'eau est poluée.