Le
Schweppes : un bon antipaludisme sans risque pour la santé ? Bac
Amérique du Nord
2025.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| . |
.
.
|
|
.
.
|
..
..
......
...
|
La
quinine reste un médicament majeur pour le traitement du paludisme. Sur
l'étiquette d'une caanette de Schweppes, on peut lire que cette boisson
contient de la quinine.
M(quinine) = 324 g / mol.
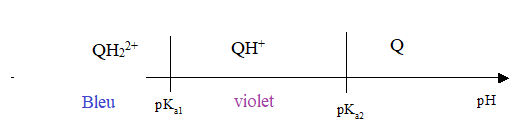
La quinine est une dibase notée Q dont les pKa valent 4,4 et 9,0 à 25°C. Les formes acides sont symbolisées par QH+ et QH22+.
Spectre d'émission de fluorescence d'une solution acidifiée de quinine :
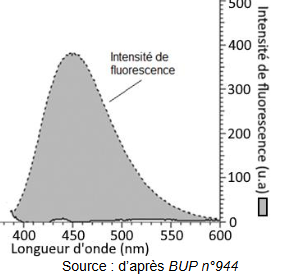
Sous irradiation UV, les formes QH+ et QH22+émettent respectivement une fluorescence violette et bleue alors que la forme Q n'est pas fluorescente.
1. Etude de la molécule de quinine.
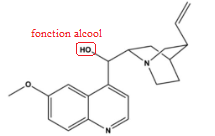
Q1. Justifier le suffixe "ol" dans le nom officiel 6-méthoxyquinolin-4-yl(5-vinylquinuclidin-2-yl)-méthanol.
Q2. Justifier à
l'aide du spectre d'émission, la couleur de la lumière émise par
fluorecence pour une solution acidifiée de quinine.
Le maximum d'absorption se situe vers 450 nm, domaine du bleu, violet.
Q.3.
Représenter le diagramme de prédominance des différentes formes
acido-basique de la quinine. En déduire les couleurs de fluorescence
attendues dans les différents domaines de pH.
Dosage par étalonnage de la quinine contenue dans le Schweppes.
Lors du dosage par fluorescence l'intensité lumineuse est proportionnelle à la concentration de l'espèce chimique fluorescente.
Ir = k I0 C.
Ir intensité de fluorescence ; k constante en L mol-1 ; C concentration en mol/ L; I0 : intensité de la source lumineuse incidente.
Protocole :
Etape1 : à partir d'une solution mère acidifiée de quinine S0 de concentration C0 = 1,20 10-5 mol / L, on prépare un volume Vf = 10,0 mL de solutions étalons de différentes concentrations Cf.
|
S1
|
S2
|
S3
|
S4
|
S5
|
Cf (mol / L)
|
5,20 10-6
|
3,25 10-6 |
1,68 10-6
|
1,30 10-6 |
0,65 10-6 |
Ir
|
728
|
480
|
253
|
219
|
116
|
Etape 2 :
on mesure l'intensité de fluorescence à 450 nm de chaque solution et on
trace la courbe donnant l'intensité de fluorescence en fonction de la
concentration.
Etape 3 : l'intensité de fluorescence mesurée pour une solution de Schweppes diluée 100 fois est égale à 319.
Q.4. Calculer la valeur du volume de solution mère à prélever pour préparer la solution S4.
Facteur de dilution F =1,20 10-5 / (1,30 10-6) =9,23.
Volume de solution mère à prélever : 10,0 / 9,23 =1,1 mL.
Q5. Indiquer le protocole à suivre pour préparer cette solution.
Prélever 1,1 mL de solution mère à l'aide d'une burette graduée ;
verser dans une fiole jaugée de 10,0 mL contenant 1 /3 d'eau distillée
; agiter ; compléter avec de l'eau distillée jusqu'au trait de jauge.
Agiter pour rendre homogène.
Q6. Justifier l'allure de la courbe obtenue Ir = f(Cf).
L'intensité lumineuse est proportionnelle à la concentration de l'espèce chimique.
Q7. Déterminer la concentration en quantité de matière en quinine dans le Schweppes.
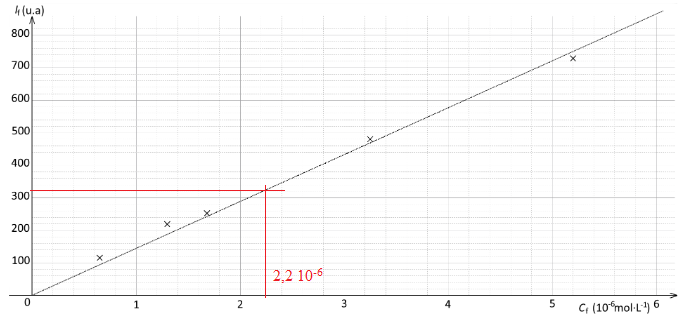
Tenir compte de la dilution : 100 x2,2 10-6 = 2,2 10-4 mol / L.
ou 324 x2,2 10-4 =0,071 g / L ou 71 mg / L.
Les boissons tonic peuvent contenir jusqu'à 100 mg / L de quinine sans inconvénient pour la santé.
Q8. Indiquer si la boisson respecte ce critère.
Oui, 71 mg / L est inférieur à 100 mg / L.
Q9. Expliquer si une personne de 50 kg peut utiliser le Schweppes pour le traitement contre le paludisme.
La quinine s'utilise par voie orale pour le traitement du paludisme à
raison de 3 prises de 8 mg / kg de masse corporelle, espacées de 8
heures, pendant 7 jours.
Masse de quinine par prise : 8 x50 =400 mg.
La boisson contient 71 mg de quinine par litre ; il faudrait donc
boire 400 / 71 = 5,6 litres de cette boisson à chaque prise : mission
impossible.
|
...
|
....
|
Titrage pH-métrique de l'acide citrique contenu dans le Schweppes.
20,0 mL de Schweppes sont placés sous agitation pendant quelques heures
dans un bécher pour dégazer la boisson. La solution est titrée par une
solution de soude à Cb = 0,100 mol / L.
L'acide citrique est un triacide :
AH3aq + 3HO-aq --> A3-aq + 3H2O(l).
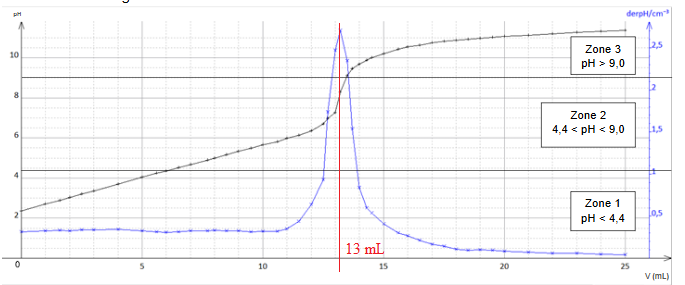
Q10. Quelles qualités doit posséder la réaction de titrage ?
Rapide, unique, totale.
Q11. Justifier le dégazage.
Le dioxyde de carbone dissout est un acide.
Q12. Déterminer la concentration C en acide citrique.
Q13. Comparer à la concentration maximale admissible 7,8 10-2 mol / L.
A l'équivalence : n(acide citrique) = 20,0 C mmol.
n(soude) = 0,100 x13 = 1,3 mmol.
n(acide citrique) = n(soude ) / 3 = 1,3 / 3 = 0,433 mmol.
C = 0,433 / 20 = 2,17 10-2 mol / L, valeur inférieure à la concentration maximale admissible.
Q14. Indiquer en
justifiant si on peut utiliser la quinine centenue dans le Schweppes
comme indicateur coloré dans le cas du dosage colorimétrique sous UV de
l'acide citrique.
Avant l'équivalence, le pH est inférieur à 6 : les formes QH+ et QH22+prédominent, la solution est bleu violet.
A l'équivalence, le pH vaut 8 : les formes QH+ et QH22+prédominent, la solution est bleu violet.
1 mL après l'équivalence, le pH est égal à 9 : QH+ et QH22+sont minoritaires.
Le changement de couleur n'est pas net à l'équivalence : on ne peut pas utiliser la quinine centenue dans le Schweppes
comme indicateur coloré dans le cas du dosage colorimétrique sous UV de
l'acide citrique.
|
|
|
|