Sciences
physique et chimique. BTS ABM analyse de biologie médicale
2025.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
| ... |
.
.
|
|
.
.
|
..
..
......
...
|
Exercice
1. Dosage de l'élément sodium dans le sang. . 13 points.
La teneur en ion sodium dans le sang est nomée "natrémie". Une natrémie normale est voisine de 140 mmol / L.
Partie A : Solubilité du chlorure de sodium et hypernatrémie.
1. Définir le terme cristal ionique.
Dans un cristal ionique lest un empilement régulier de cations et d'anions : le solide est électriquement neutre.
Les liaisons entre les ions sont de nature essentiellement ionique.
2.1. Ecrire l'équation de dissolution du chlorure de sodium dans l'eau.
NaCl(s) --> Na+aq +Cl-aq.
2.2. Calculer l'enthalpie standard de dissolution du chlorure de sodium solide et commenter son signe..
DH =DHf°(Na+aq) +DHf°(Cl-aq) -DHf°(NaCl s)= -240,3 -167,1+411,2=3,8 kJ / mol.
La dissolution est endothermique.
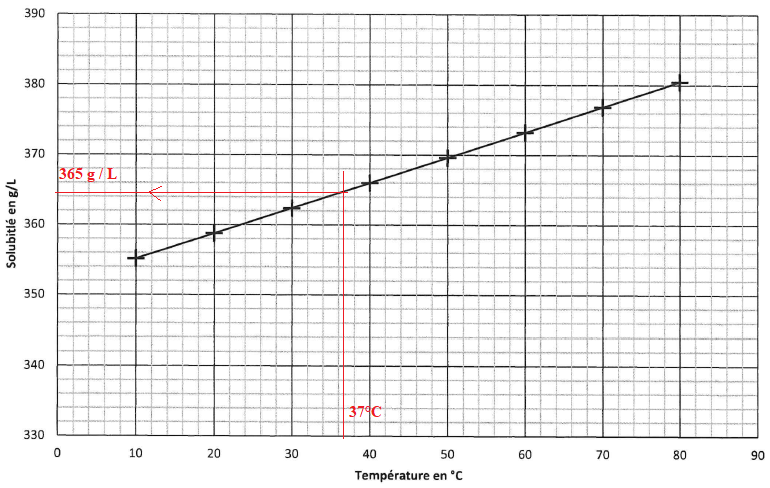
2.3. D'après la courbe ci-dessus, décrire comment la solubilité du chlorure de sodium évolue avec la température.
La solubilité augmente avec la température.
2.4. Justifier cette évolution.
La dissolution est endothermique, elle est donc favorisée par une élévation de température. ( principe de Le Chatelier).
3.1. Relever la valeur de la solubilité du chlorure de sodium dans l'eau à 37 °C puis l'exprimer en mmol / L.
365 g / L; 365 / M(NaCl) = 365 / 58,5 =6,24 mol / L = 6240 mmol/ L.
3.2.
Montrer qu'en pourcentage le rapport entre la quantité de matière de
sodium dissous dans 1 L de plasma d'une personne ayant un taux de
natrémie normale et la quantité maximale que l'on pourrait dissoudre
dans le même volume de plasma vaut moins de 3 %.
140 / 6240 =0,022 ou 2,2 %.
3.3. Justifier qu'une alimentation trop riche en sel alimentaire peut conduire à une hypernatrémie.
Les ions sodium ne sont pas transformés lors de la digestion.
Un apport excessif en sel augmente la concentration en ion Na+. Si l'excrétion rénale est saturée, l'excès d'ion sodium non éliminé provoque une hypernatrémie.
Partie
B : Principe de la photométrie d'émission de flamme.
Le nébuliseur disperse en fines gouttelettes la solution.
Le brûleur / la flamme atomise l'ion à doser puis excite l'atome formé.
Le monochromateur permet de sélectionner la longueur d'onde
caractéristique du rayonnement produit par l'atome formé ( 589 nm dans
ce cas).
Le dispositif de détection et de traitement permet de détecteret d'amplifier le signal.
4.1. Calculer
en joule puis en eV l'énergie transportée par le photon de
longueur d'onde 589 nm émis lors du retour à l'état fondamental.
E = h c / l =6,67 10-34 x 3,0 108 / (589 10-9) =3,37 10-19 J.
3,37 10-19 / (1,6 10-19)=2,11 eV.
4.2. Indiquer par une flèche sur le diagramme simplifié des niveaux d'énergie la transition correspondante.

5. Citer deux exemples de dispositifs optique pouvant jouer le rôle de monochromateur.
Réseau de diffraction et prisme.
Partie C. Dosage du sodium dans le sang par photométrie.
On utilise l'élément lithium (Li) comme étalon interne : sa longueur d'onde caractéristique est de 671 nm.
Une gamme de solutions de concentrations connues est fabriquée à partir :
d'une solution de chlorure de sodium de concentration 10,0 mmol /L.
d'une solution de chlorure de lithium de concentration 5,00 mmol / L.
Chaque mélange est préparé dans une fiole jaugée de 100 mL avec de l'eau distilée.
On mesure l'intensité émise par le sodium ( Ii) et le lithium (Iet) pour les 5 solutions.
Si =ieme solution étalon
|
S0
|
S1
|
S2
|
S3
|
S4
|
S5
|
Vi ( mL) NaCl
|
0
|
1,00
|
2,00
|
5,00
|
7,00
|
10,0
|
Vet (mL) LiCl
|
0
|
10,0
|
10,0
|
10,0
|
10,0
|
10,0
|
Concentration en ion sodium Ci (mmol /L)
|
0
|
0,100
|
0,200
|
0,500
|
0,700
|
1,00
|
| Concentration en ion lithium Cet (mmol /L) |
0
|
0,500
|
0,500
|
0,500
|
0,500
|
0,500
|
Ci / Cet
|
0
|
0,200
|
0,400
|
1,00
|
1,40
|
2,00
|
Ii / Iet
|
0
|
0,232
|
0,470
|
1,32
|
1,83
|
2,79
|
6. Décrire le protocole à mettre en oeuvre lors de la préparation de la solution S3.
Prélever 5,00 mL de solution de NaCl à 10,0 mmol/ L à l'aide d'une pipette jaugée.
Verser dans une fiole jaugée de 100,0 mL
Ajouter 10,0 mL de solution de LiCl à 5,00 mmol/ L à l'aide d'une pipette jaugée de 10,0 mL.
Verser dans la fiole jaugée de 100,0 mL
Compléter avec de l'eau distillée jusqu'au trait de jauge.
Boucher,agiter par retournements pour rendre homogène.
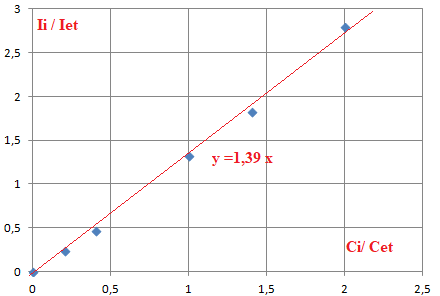
7. Représenter la courbe donnant les variations de Ii / Iet en fonction de Ci / Cet.
On prépare la solution S à analyser contenant l'échantillon sanguin à doser.
L'échantillon sanguin est dilué 400 fois. On prélève 90 mL de cet
échantillon et on les verse dans une fiole jaugée de 100 mL. On ajoute
10,0 mL d'une solution de chlorure de lithium de concentration 5,00
mmol / L.
La mesure donne Is / Iet = 0,951.
8. Montrer que la concentration molaire en ion lithium dans la solution S vaut Cet = 0,500 mmol / L.
5,00 x 10 =50,0 mmol d'ion lithium dans 100 mL
50,0 / 100 = 0,500 mmol / L.
9. Déterminer la concentration en ion sodium dans cet échantillon et conclure.
Ii / Iet = 1,39Ci / Cet = 0,951.
Ci / Cet = = 0,951 / 1,39=0,684.
Ci = 0,684 x5,00 =3,42 mmol / L.
Tenir compte de la dilution : 3,4210-3x400 =1,37 mmol / L.
La natrémie est normale.
|
...
|
....
|
Exercice 2. L'acébutolol contre l'hypertension artérielle. 7 points.
10. Définir le terme carbone asymétrique.
Un carbone asymétrique est un atome de carbone tétragonal lié à 4 atomes ou groupes d'atomes différents.
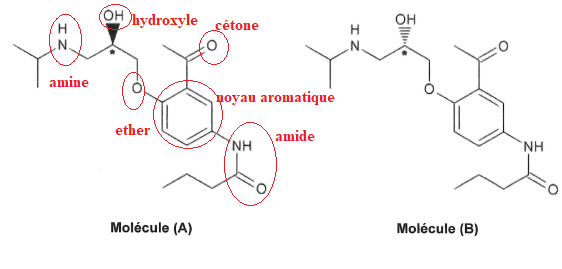
11.Entourer et nommer les différents groupements caractéristiques de cette molécule.
12 Déterminer la configuration absolue du carbone asymétrique dans la molécule A.
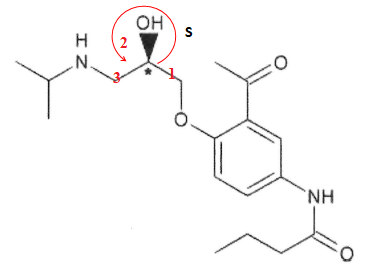
13. Indiquer la relation de stéréoisomérie entre les molécules A et B.
A et B sont des énantiomères.
On s'intéresse à la première étape de la synthèse de l'acébutolol
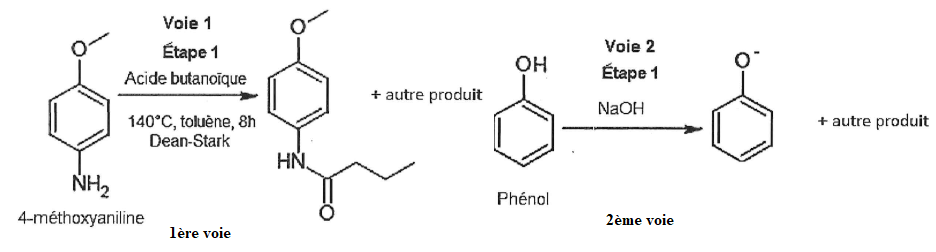
14. Donner la formule semi-développée de l'acide butanoïque, espèce réagissant au cours de l'étape 1 avec la 4-méthoxyaniline.
H3C-CH2-CH2-COOH
15. Indiquer la nature de la transformation chimique mise en jeu dans l'étape 1 de la voie 2.
Réaction acide base entre le phénol ( acide) et la soude NaOH ( base).
16.
Préciser la formule chimique et le nom du second produit formé dans
l'étape 1, sachant qu'il s'agit du même produit pour les deux voies de
synthèse.
H2O, eau.
|
|
|
|