|
Chaufferette chimique : bac S France 09 / 2011. |
|||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||
|
L'éthanoate de sodium CH3COONa est un solide blanc. En solution aqueuse il donne, entre autre, l'ion éthanoate CH3COO-. Pourquoi l'ion éthanoate est-il une base selon Brönsted ? En déduire le couple acide / base correspondant. L'ion éthanoate CH3COO- est susceptible de gagner un proton, c'est doncu ne base selon Brönsted. CH3COO- + H+ = CH3COOH. Couple acide / base CH3COOH aq / CH3COO-aq ( ion éthanoate / acide éthanoïque ( acétique)). On introduit dans un becher un volume V =100 mL d'une solution S d'éthanoate de sodium dont la quantité de matière en soluté apporté est n= 1,0 10-2 mol. Le pH de la solution est égal à 8,9. L'équation de la réaction chimique entre l'ion éthanoate et l'eau est : CH3COO-aq +H2O(l) =CH3COOH aq + HO-aq.
Une chaufferette chimique contient une solution aqueuse S0 d'éthanoate de sodium (CH3COO-aq + Na+aq). Le volume de la solution est V0 = 100 mL et sa masse est m =130 g. La solution S0 étant trop concentrée pour être dosée directement, on prépare une solution S1 en diluant 100 fois S0. Titrage de la solution S1. On place dans un becher un volume V1 = 25,0 mL de S1. On réalise un titrage par pHmétrie par une solution d'acide chlorhydrique ( H3O+aq+Cl-aq) de concentration cA = 0,20 mol/L. On note VA le volume de la solution d'acide chlorhydrique versé. L'équation de la réaction chimique support du dosage s'écrit : H3O+aq + CH3COO-aq = CH3COOH aq +H2O(l). Schématiser et légender le dispositif de titrage. 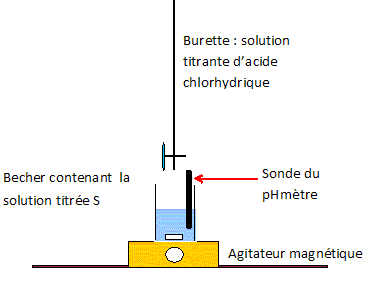
Après avoir défini l'équivalence, écrire la relation entre la quantité de matière initiale d'ion éthanoate et la quantité de matière d'ion oxonium introduits à l'équivalence. A l'équivalence, les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. Avant l'équivalence, l'un des réactifs est en excès, après l'équivalence, l'autre réactif est en excès. n(H3O+aq) = CAVA eq ; n(CH3COO-aq) =V1 [CH3COO-aq]1. CAVA eq = V1 [CH3COO-aq]1. Déterminer le volume équivalent en expliquant la méthode utilisée. On utilise la méthode des tangentes ou encore, on remarque que la courbe dérivée présente un maximum à l'équivalence. 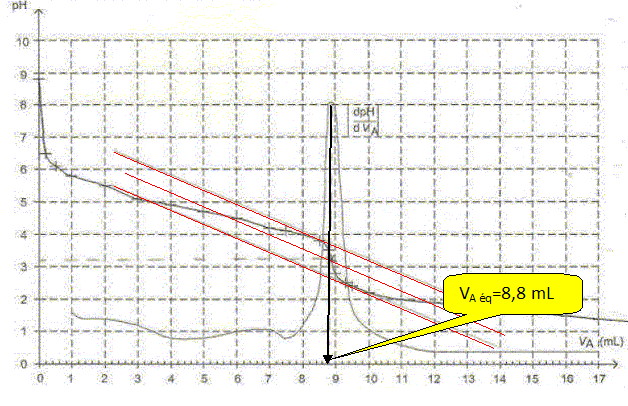 Calculer la concentration c1 en ion éthanoate dans la solution S1. [CH3COO-aq]1 = CAVA eq =/ V1 =0,20*8,8 /25=0,0704 ~0,070 mol/L.
|
|||||||||||||||||||||||||||||
|
|