|
Dosage d'un antiseptique: bac ST2S Antilles 2011. |
|||||||
|
|||||||
|
L’antiseptique emporté par le marcheur contient du diiode I2 en solution aqueuse. L’étiquette du flacon indique « solution de diiode à 1% ». Cette solution commerciale se conservant mal, le marcheur a vérifié la concentration en diiode C0 avant de partir. Pour cela, il a effectué un dosage du diiode par l’ion thiosulfate S2O32-. Dilution de la solution commerciale S0. Le dosage a été réalisé en utilisant la solution commerciale S0 diluée 10 fois. La solution diluée, appelée S, a une concentration en diiode notée C. Donner la relation entre les concentrations C et C0. C = 0,1 C0. Calculer le volume V0 de solution S0 prélevé pour préparer un volume V = 200 mL de solution diluée S. V0=V/10 = 200/10 = 20 mL.
Nommer le matériel et les solutions correspondant à chaque numéro du dispositif de dosage représenté ci-dessous. 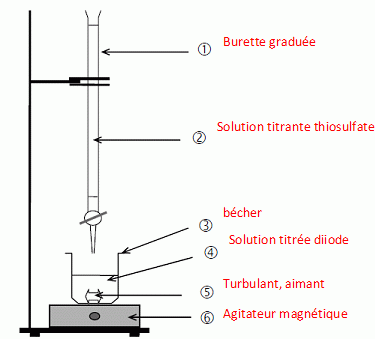 Donner la définition de l’équivalence d’un dosage. A l'équivalence, les quantités de matière des réactifs mis en présence sont en proportions stoéchiométriques. Avant 'équivalence, l'un des réactifs est en excès, après l'équivalence, l'autre réactif est en excès. Montrer que la relation à l’équivalence est : CT .VTE = 2 C.V1. Quantité de matière de thiosulfate : CT .VTE ; quantité de matière de diiode : C.V1. Or une mole de diiode réagit avec deux moles de thiosulfate. C.V1 mole de diiode réagit avec 2C.V1 moles de thiosulfate. CT .VTE = 2 C.V1. En déduire que la concentration molaire en diiode I2 de la solution diluée S est : C = 3,9 × 10-3 mol.L-1. C = CT .VTE /( 2 V1 ) = 5,0 x 10-3 *15,6 / (2*10) =3,9 × 10-3 mol.L-1.
Exploitation du résultat du dosage. Calculer la concentration molaire en diiode C0 de la solution commerciale S0. C0 = 10 C = 3,9 × 10-2 mol.L-1. En déduire que la quantité de matière n0 de diiode contenue dans un flacon de 100 mL de solution commerciale S0 vaut n0 = 3,9 × 10-3 mol. n0 = C0 fois volume (litre) de la solution = 3,9 × 10-2 *0,100 = 3,9 × 10-3 mol. Calculer la masse m0 de diiode contenue dans le flacon. Donnée : M(I2) = 254 g.mol -1. m = n0 M(I2) =3,9 × 10-3 *254 =0,9906 ~0,99 g. Le flacon contient 100 g de solution. L’indication de l’étiquette est-elle vérifiée ? Donnée : une solution à x % en masse contient x g de soluté pour 100 g de solution. « solution de diiode à 1% » soit 1 g de diiode pour 100 g de solution. Ecart relatif : 1-0,99 / 1 *100 =1%. A 1 % près l'indication de l'étiquette est vérifiée.
|
|||||||
|
|