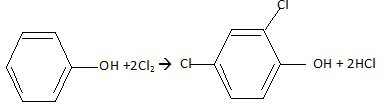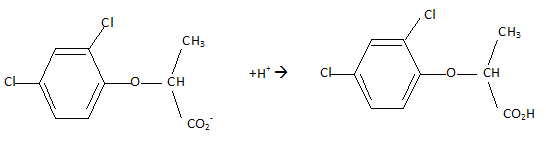|
Dosage de l'acide oxalique ;
spectrophotométrie : suivi cinétique, violet cristallisé, étude d'un
herbicide : bac STL
09/10 |
|||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||
|
On donne : pKa1(C2H2O4 / C2HO4-)=1,3 ; pKa2(C2HO4- / C2O42- )=4,3 ; Ks(CaC2O4) =3,6 10-9 à 37°C ; M(CaC2O4) =128 g/mol. Exprimer les constantes d'acidité Ka1 et Ka2 en fonction des différentes concentrations. C2H2O4 +H2O = C2HO4- +H3O+. Ka1= [C2HO4-] [H3O+] / [C2H2O4] C2HO4- +H2O = C2O42- +H3O+. Ka2=[C2O42-] [H3O+] / [C2HO4-] Sur un axe gradué en unité pH, placer les espèces majoritaires de l'acide oxalique. 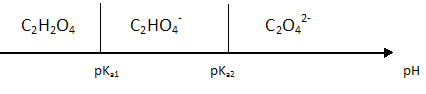 La courbe de dosage pH-métrique de E = 10,0 mL d'une solution d'acide oxalique de concentration CAOx =0,0800 mol/L par une solution d'hydroxyde de sodium de concentration CB =0,100 mol/L est donnée. 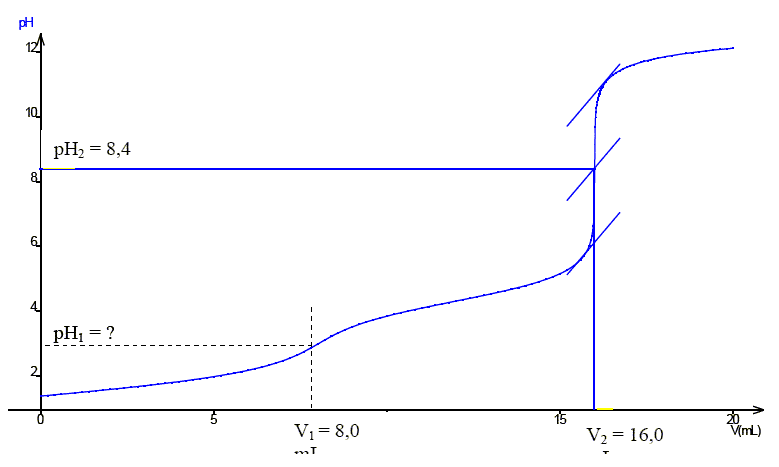 Indiquer l'espèce qui impose le pH à la première équivalence. Préciser sa aprticularité acido-basique. L'espèce C2HO4- impose le pH à la première équivalence ( pH ~ 3) ; C2HO4- peut se comporter comme un acide ou comme une base : C2HO4- est amphotère. Donner la valeur de pH1. ( aucune démonstration n'est demandée ) pH1 = ½(pKa1 +pKa2) =0,5(1,3 +4,3) = 2,8. Ecrire l'équation de la réaction qui a lieu entre les deux équivalences. C2HO4-aq +HO-aq = C2O42-aq + H2O(l). Quelle est l'espèce qui impose le pH de la deuxième équivalence ? A pH =8,4, l'espèce C2O42-aq est majoritaire et impose le pH. Montrer en justifiant que la concentration de cette espèce à l'équivalence est égale à 3,08 10-2 mol/L. Conservation de l'élément carbone : [C2H2O4aq] + [C2HO4-aq] +[C2O42-aq] = CAOx E / (E+V2). A pH >> pKa2 : [C2O42-aq] ~CAOx E / (E+V2) =8,00 10-2 *10 / (10+16) =3,08 10-2 mol/L.
Solubilité
de l'oxalate de calcium. Quantité de matière d'oxalate de calcium : n = m / M = 0,77 / 128 =6,016 10-3 mol. Volume d'eau à boire : 6,016 10-3 / 6,0 10-5 =1,0 102 L. Le volume d'eau serat-il plus ou moins important si l'eau est calcique ( contenant des ion calcium) ? Justifier qualitativement. En présence d'un ion commun, l'ion calcium, la solubilité de l'oxalate de calcium diminue. Cinétique de décoloration du violet cristallisé. Le violet cristallisé, ou cristal violet, est un colorant de couleur violette. Il est essentiellement employé en microbiologie pour le marquage de bactéries. C'est aussi un indicateur de pH dont la zone de virage se situe entre 0 et 1,8. La forme violette du violet cristallisé est observée dès pH = 2. Cette forme sera notée V+. En milieu fortement basique une solution de violet cristallisé se décolore : V+ + OH- --> VOH. Cette réaction est lente. Comme le violet cristallisé est coloré, alors que VOH ne l'est pas, il est possible d'étudier la cinétique de la réaction par spectrophotométrie. On cherche à déterminer l'ordre partiel par rapport au violet cristallisé V+. Dans un becher de 200 mL, on introduit 20,0 mL d'une solution de concentration molaire C = 7,4 10-5 mol/L en violet cristallisé ainsi que 75 mL d'eau distillée. A t=0 on déclenche un chronomètre tout en ajoutant 5,0 mL d'une solution d'hydroxyde de sodium à 0,10 mol/L. On réalise des prélèvements du milieu réactionnel à différents instants. Ces prélèvements sont introduits dans une cuve pour spectrophotomètre, elle-même placée dans de la glace quelques minutes pour stopper la réaction. On mesure l'absorbance A des différents prélèvements à une longueur d'onde de 590 nm. Les résultats sont consignés dans le tableau suivant :
Calculer les concentrations molaires initiales dans le mélange, en violet cristallisé [V+]0 et en hydroxyde de sodium [HO-]0. Volume total de la solution V = 100 mL = 0,10 L. [V+]0 = 0,020 * 7,4 10-5/0,10 = 1,48 10-5 ~ 1,5 10-5mol/L [HO-]0 = 0,0050*0,10 / 0,10 =5,0 10-3 mol/L Indiquer quelle hypothèse on peut faire concernant la concentration en hydroxyde de sodium au cours de la réaction. L'hydroxyde de sodium est en large excès par rapport au violet cristallisé : la concentration de l'ion hydroxyde peut être considérée comme constante. Exploitation des résultats. La réaction de décoloration du violet cristallisé est d'ordre 1 par rapport à chacun des réactifs. Donner la loi de vitesse de la réaction de décoloration du violet cristallisé, en notant k la constante de vitesse. v = d[VOH]/dt = - d[V+] /dt = k [V+][HO-]. En tenant compte de l'hypothèse ci-dessus [HO-] ~[HO-]0 ~ constante ; on pose k' = k[HO-]0 d'où : v = - d[V+] /dt = k' [V+]. Montrer que ln ([V+] / [V+]0) = -k't. - d[V+] /dt = k' [V+] s'écrit : d[V+] / [V+] = -k' dt. Intégrer : ln [V+] = -k't + cste ; ln [V+]0 = cste ; ln [V+] = -k't +ln [V+]0 ; ln [V+]-ln [V+]0 = -k't ; ln ([V+] / [V+]0) = -k't. En utilisant la relation de Beer-Lambert, montrer que ln (A/A0) = -k't. Aux faibles concentrations, l'absorbance A est proportionnelle à la concentration en violet cristallisé : A = cste [V+] ; A0 =cste [V+]0 ; [V+] / [V+]0 =A/A0 ; ln (A/A0) = -k't. Représenter le graphique ln(A) = f(t). 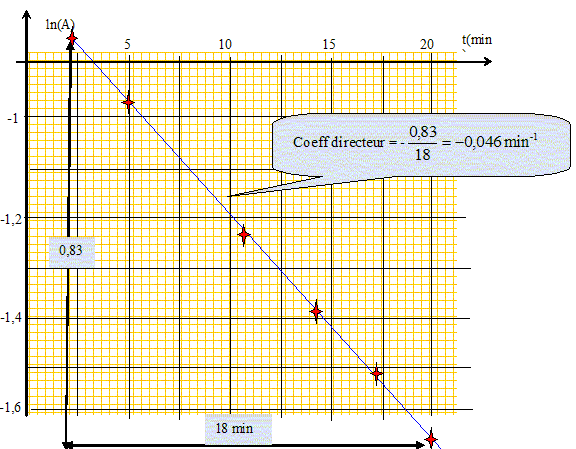 Déduire de
la courbe précédente que la réaction est bien d'ordre 1 par rapport à V+.
Donner la valeur de k'.
Etude d'un herbicide. Les acides phénoxyalcanoïques sont des herbicides sélectifs détruisant les plantes à larges feuilles. leurs synthèses industrielles sont réalisées à partir du phénol. La molécule de 2,4 DP, un herbicide, est donnée : Indiquer le nom des fonctions chimiques oxygénées présentes. 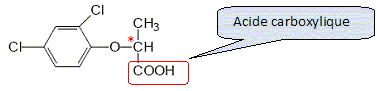 Acide carboxylique et ether oxyde d'un dérivé du phénol. Expliquer pourquoi la molécule de 2,4 DP est chirale. La molécule possède un atome de carbone asymétrique et aucun élément de symétrie : la molécule est donc chirale. Dessiner en représentation de Cram les stéréoisomères de configuration du 2,4 DP. Donner la configuration absolue ( R ou S ). 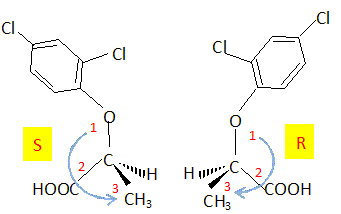 Indiquer comment est appelé ce type d'isomérie. Isomérie optique ou énantiomérie. Par quelle propriété physique ces stéréoisomères diffèrent-ils ? Donner le nom de l'appareil que l'on peut utiliser pour montrer cette propriété. Ces isomères dévient le plan de la lumière polarisée en sens contraire. On utilise un polarimètre.
|
|||||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||||
|
|