.
|
|
Le
super éthanol E85.
L'éthanol est un biocarburant issude cultures végétales ( betteraves,
canne à sucre, céréales...) qui constitue une alternative possible à
l'essence traditionnelle.
L'utilisation
de l'éthanol pur comme carburant pose un certains nombre de
difficultés, notamment de démarrage à froid. C'est pourquoi, en Europe,
on le trouve mélangé à de l'esence. Cependant, l'utilisation de ce type
de carburant dans un véhicule "flex-fuel" qui peut utiliser 2 ou 3 type
de carburant ) entraîne une surconsommation par rapport à l'essence
pure. On donne le graphique donnant la
surconsommation du moteur en fonction du pourcentage volumique
d'éthanol dans le carburant.
Le superéthanol E85 est constitué en volume de 85 % d'éthanol et de 15
% d'essence.
Déterminer
graphiquement le pourcentage de surconsommation lié à l'utilisation du
biocarburant E85.
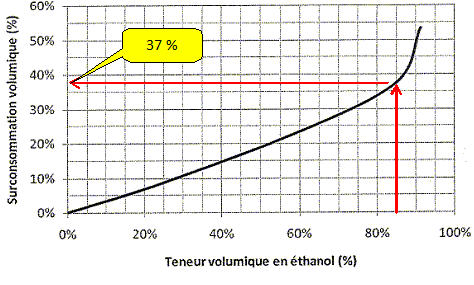
Justifier
qu'il ne serait pas judicieux de dépasser la valeur de 85 %.
La surconsommation croît très rapidement, le graphe
se rapproche de la verticale.
Un constructeur indique une consommation moyenne de 6,80 L aux 100 km
pour une véhicule "flex-fuel" fonctionnant à l'essence.
En déduire
sa consommation moyenne pour un fonctionnement au carburant E85.
6,80
*1,37 = 9,316~9,3 L.
L'essence est
principalement constituée d'octane C8H18.
On donne l'équation de la réaction de
combustion complète de l'octane :
2C8H18 + 25O2
---> 16 CO2 + 18 H2O.
L'éthanol a pour formule C2H6O.
Ecrire
l'équation complète de 2 moles d'éthanol.
2C2H6O
+6O2 ---> 4 CO2
+ 6 H2O.
En
déduire que la combustion d'une mole d'octane rejette davantage de
dioxyde de carbone que celle d'une mole d'éthanol.
Une mole d'octane libère 8 moles de CO2. Une mole
d'éthanol libère seulement 2 moles de CO2.
|
On
donne les masses de dioxyde de carbone rejeté lors de la combustion
d'un litre d'essence et d'éthanol ainsi que les pourcentages volumiques
des combustibles présents dans le carburant E85.
| Combustible |
essence |
éthanol |
| Rejet de CO2
en gramme par litre consommé |
2310 |
1520 |
| Pourcentage
volumique dans le superéthanol E85 |
15% |
85% |
Calculer
la masse de dioxyde de carbone rejeté par litre de carburant E85
consommé.
2310*0,15 + 1520 * 0,85 = 346,5 + 1292 = 1638,5 ~1,6 103
g ~ 1,6
kg.
Calculer
la masse de CO2 rejeté ( en kg ) pour 100 km
parcourus par un véhicule utilisant de l'essence.
6,8 L d'essence sont consommés : 6,80 *2,31 =15,708~15,7 kg.
Calculer
la masse de CO2 rejeté ( en kg ) pour 100 km
parcourus par un véhicule utilisant de du carburant E85.
9,3 L de
carburant E85 sont consommés : 9,316 *1,638 =15,26 ~15,3 kg.
En
déduire la différence de rejet de CO2 pour 100
km parcourus.
15,708 -15,26 =0,448 ~ 0,45 kg de moins pour le carburant E85. A cela,
il faut tenir compte du fait que betteraves,
canne à sucre, céréales ont fixé du dioxyde de carbone lors de leur
croissance.
Pour un parc automobile de 20 millions de véhicules parcourant en
moyenne 20 000 km par an chacun, calculer
la masse de dioxyde de carbone ( en millions de tonnes ) qui
ne sera pas rejeté dans l'atmosphère si on utilise le
carburant E85.
20 000 km = 200 * 100 km ; 0,448 kg = 0,448 10-3
t.
20 *200 * 0,448 10-3
= 1,8
millions de tonnes.
La
pile à combustible.
La pile à combustible est un
générateur intéressant dans la mesure où elle ne rejette que de l'eau.
Il s'agit de produire de l'énergie électrique en réalisant la synthèse
de l'eau suivant l'équation chimique :
2H2(g) +O2(g) --->
2H2O(l).
On étudie un véhicule muni d'une telle pile alimentant un moteur
électrique.
Le dihydrogène est stocké sous forme gazeuse dans un réservoir en
matériau composite et sera assimilé à un gaz parfait. On donne la
constante des gaz parfaits R = 8,31 J mol-1 K-1.
Ce gaz est stocké dans un réservoir de volume V = 0,150 m3
à la température ambiante q
= 20°C sous une pression p = 410 bars.
Montrer
que la quantité de matière de dihydrogène est n = 2,53 103 mol.
PV = nRT avec P = 4,10 107 Pa ; T = 273+20 = 293
K.
n = PV / (RT) = 4,10
107 *0,150 / (8,31 *293) =2,5258 103
~2,53
103
moles.
Calculer
la masse de dihydrogène. M(H2) =
2,00 g/mol.
m = n M(H2)
=2,5258 103
*2,00 =5,0517 103 g ~5,05
kg.
La réaction de synthèse de l'eau libère une énergie de 120 MJ par kg de
dihydrogène consommé.
Calculer
l'énergie électrique totale susceptible d'être produite par la pile
après utilisation totale du dihydrogène contenu dans le réservoir.
120 *5,0517 =606,2 ~606 MJ.
On
souhaite évaluer l'autonomie du véhicule lors d'un trajet à vitesse
constante v = 110 km / k. l'énergie dépensée pour faire avancer le
véhicule vient alors compenser l'énergie perdue par frottements. La
valeur de la force de frottement est f = 400 N.
Montrer
que la puissance développée par le moteur au cours du trajet est Pu
= 12,2 kW.
Pu
= f v avec v = 110 / 3,6 = 30,555 m/s.
Pu
=400 *30,555 =1,22 104 W = 12,2 kW.
A cette vitesse, on considère que l'ensemble "pile moteur, transmission
" a un rendement de 35%..
Calculer
l'énergie mécanique utile.
606,2*0,35 =212,17 ~ 212 MJ.
En
déduire la durée maximale ( en heures ) du trajet effectué à
110 km/h.
212,17 MJ = 2,1217 106 J ; durée = 2,1217 108
/ 1,22
104 = 1,739 104
s ~4,83
heures.
On s'intéresse à l'utilisation de la pile à combustible pour un parc
automobile de 20 millions de véhicules parcourant en moyenne 20 000 km
par an.
Calculer
le volume de dihydrogène ( millions de m3 )
nécessaire en une année pour l'ensemble des véhicules.
Ce volume est calculé sous une pression de 410 bars.
20 *20 000 / 531 =753,3 millions de réservoirs pleins soit 753,3 *0,150
~ 113
millions de m3.
Donner
le nom de la technique industrielle la plus courante de production de
dihydrogène.
Il est produit principalement par reformage de combustibles fossiles ou
par électrolyse de l'eau. Le principal procédé est le vaporeformage du
méthane sous l'effet de la vapeur d'eau.
Quel
inconvénient majeur présente la production massive de ce gaz
?
Le mélange dihydrogène - air est explosif, pratiquement en toutes
proportions..
|
|
