L'arôme
de vanille, ingrédient utilisé dans la préparation de nombreux
désserts, provient en grande partie de la vanilline, composé aromatique
très puissant. Les gousses de vanille contiennent peu de vanilline :
dans 1 kg de gousses, il y a 25 g de vanilline. Le prix de revient de
la vanille est élévé : les extraits de vanille naturelle coûtent plus
de 1500 € le kilogramme. De ce fait, la vanilline commercialisée peut
contenir de la vanilline synthétique, dont le prix de revient est
beaucoup plus faible.
La vanilline naturelle manifeste une activité liée à la présence du
carbone 14, comme dans toute substance végétale, suivant le mécanisme
décrit ci-après.
Dans la nature l'élément carbone possède deux noyaux isotopes : le carbone 12 noté 126C et le carbone 14 noté 146C.
Ce carbone 14 est spontanément radioactif ß- et a une période ou temps de demi-vie T égale à 5570 ans.
On note N(t) le nombre de noyaux radioactifs présents à l'instant t dans l'échantillon.
L'activité
A(t) mesurée en becquerel ( Bq) d'un échantillon radioactif est le
nombre de désintégrations qu'il produit par seconde soit :
A(t) = -dN(t) /dt = l N(t) avec l la constante de désintégration radioactive de ce noyau.
|
|
Dans
la matière vivante, les échanges d'élément carbone entre l'organisme
végétal ou animal et l'air atmosphérique font que le rapport N(carbone
14) / N(carbone 12) est constant. A lamort de la matière vivante, ces
échanges prennent fin ce qui entraîne la décroissance de ce
rapport. C'est lecas pour les gousses de vanille à partir de la récolte.
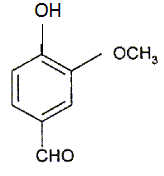
On donne NA =6,02 1023 mol-1 ; ZC) = 6 ; Z(N) = 7. Formule de la vanilline C8H8O3.
On
se propose de déterminer la proportion de vanilline naturelle dans un
échantillon à partir de la mesure de l'activité de celui-ci.
Réaction nucléaire.
Citer les lois de conservation permettant l'écriture des équations des réactions nucléaires.
Le nombre de charge se conserve ; le nombre de nucléons se conserve.
Ecrire l'équation de désintégration du carbone 14.
146C ---> 147N + 0-1e.
Définir la période ou temps de demi-vie.
La période est la durée au bout de laquelle l'activité initiale est divisée par deux..
Exprimer puis calculer la constante de désintégration radioactive du carbone 14, l en s-1.
l = ln2 / T avec T = 5570*365*24*3600 =1,75656 1011 s.
l = ln2 /1,75656 1011 =3,946 10-12 s-1.
|
.
La vanilline naturelle pure.
La
vanilline naturelle renferme une faible proportion de molécules
marquées au carbone 14, chacune ne comportant qu'un seul atome de 146C.
L'activité A, à un instant t, d'un gramme de vanilline naturelle a pour valeur 7200 Bq.
Calculer le nombre N, à l'instant t, de molécules marquées au carbone 14 dans une masse m = 1,00 g de vanilline naturelle.
N = A / l = 7200 / 3,946 10-12 =1,825 1015.
Calculer la masse molaire de la vanilline.
Formule de la vanilline C8H8O3.
M = 8*12+8+3*16 = 152 g/mol.
En déduire le nombre total N' de molécules dans une masse m = 1,00 g de vanilline naturelle.
N' = m /M NA =1,00 / 152 *6,02 1023 =3,96 1021.
En déduire la proportion de molécules marquées.
N/N' = 1,825 1015/ 3,96 1021= 4,61 10-7.
La vanilline mixte.
Un échantillon de masse 1,00 g de vanilline présente une activité de
1200 Bq, due uniquement à la vanilline naturelle. Il peut contenir
également de la vanilline synthétique d'activité nulle.
Déterminer la proportion de vanilline naturelle dans cet échantillon.
L'activité est proportionnelle au
nombre d'atomes de carbone 14, c'est à dire au nombre de molécules de
vanilline naturelle contenue dans l'échantillon.
A un activité 6 fois plus faible ( 1200 = 7200 / 6 ) correspond donc
1/6 =0,167 ( 16,7 %) de vanilline naturelle dans l'échantillon.
|
|
