|
.
|
|
Plusieurs
substances ont été synthétisées pour remplacer les produits naturels.
Elles présentent toutes un squelette de type décaline avec trois atomes
ou groupements axiaux en positions relatives1, 2, 4.
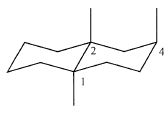
La
décaline est l'association de deux cycles cyclohexaniques. On considère
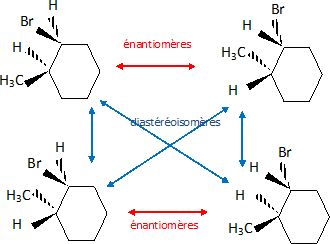
le 1-bromo-2-méthylcyclohexane.
Représenter
tous les stéréoisomères de confuguration ; indiquer les relations de
stéréo-isomérie entre eux.
Placer le cycle dans le plan de la feuille.
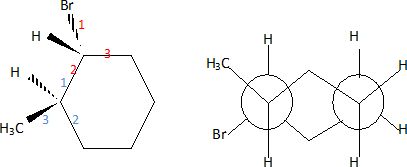
Dessiner en
perspective et en représentation de Newmann, le (1R,
2R)-1-bromo-2-méthylcyclohexane dans sa conformation la plus stable.
On donnera le classement, brièvement justifié, des substituants des
centres asymétriques.
Numéroter
de façon décroissante chacun des quatre substituants selon son numéro
atomique.
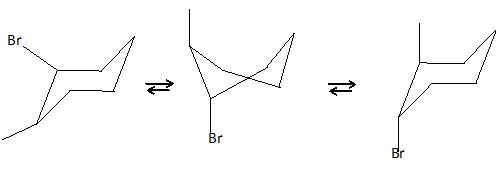
Présenter,
sur cet exemple l'interconvection chaise-chaise.
La rotation est libre autour des liaisons simples carbone-carbone. La
répulsion est minimale entre les électrons de liaisons dans les
conformations décalées.
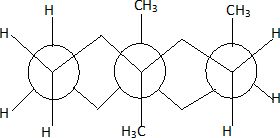
Dessiner
en représentation de Newmann, la décaline avec trois groupes méthyle
axiaux en position 1,2, 4.
|
.
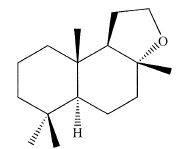
L'une
des molécules produites industriellement à parfum ambrée est le 3a, 6,
6, 9a-téraméthyldodécahydronaphto[2, 1-b]furane, commercialisée sous le
nom d'Ambrox, représentée ci-après.
La synthèse présentée ci-après part du scaréol : la chaîne latérale
subit une coupure oxydante pour donner une molécule qui se cyclise
spontanément en lactone. La réaction de cyclisation est une
estérification.

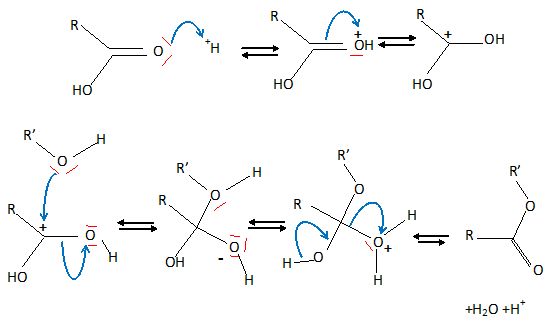
Donner le
mécanisme d'une estérification entre un acide carboxylique RCOOH et un
alcool primaire R'OH, en milieu acide.
Au vu de l'estérification intramoléculaire en oeuvre dans la synthèse
étudiée, expliquer
pourquoi le mécanisme n'est pas le même. Proposer un mécanisme
compatible avec le résultat.
Un alcool tertiaire donne facilement un carbocation. Le carbone porteur
du groupe OH a perdu sa configuration de départ. La liaison C-O est
donc coupée, ce qui est incompatible avec le mécanisme précédent.
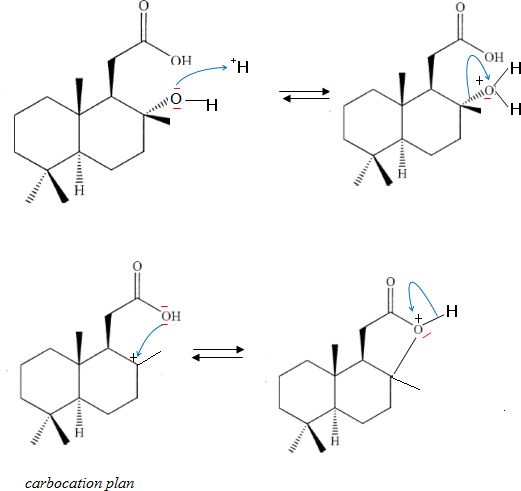
Le
carbocation intermédiaire étant plan, on obtient deux disatéréoisomères.
La lactone (
stéréo-isomères B1 et B2 ) est réduite en
dialcool C ; une déshydratation intramoléculaire conduit ensuite à un
mélange de deux stéréo-isomères, dont l'un est l'Ambrox.
Proposer
un réactif et indiquer les conditions permettant la transformation de
la lactone en dialcool C.
LiAlH4 dans l'éther éthylique anhydre ; puis hydrolyse acide.
Indiquer
si l'on peut envisager une séparation aisée de l'Ambrox et de son
stéréoisomère D. Justifier. Proposer une méthode de séparation.
Deux diastéréo-isomères ayant des températures de changement
d'état et des solubilités différentes, leur séparation est aisée :
cristallisation fractionnée ou distillation fractionnée selon leur état
physique ; chromatographie sur colonne.
|
|








