|
|
Les
solutions aqueuses d'acide phosphorique de qualité alimentaire ont une
densité comprise entre 1,6 et 1,7 pour un pourcentage massique d'acide
phosphorique allant de 75 à 85 %.
Indiquer
comment préparer 1,00 L d'une solution d'acide phosphorique à 0,10
mol/L à partir d'une solution commerciale ( 75 % en masse, densité d =
1,60).
Solution commerciale : masse d'acide pur dans 1 L : 1,60 *0,75 =1,2 kg ;
concentration : 1,2 103 / M(acide phosphorique) = 1,2 103 / 98 =12,2 mol/L.
Facteur de dilution F = 12,2 / 0,1 = 122.
Prélever 1000 / 122 ~8,2 mL de solution commerciale à l'aide d'une
pipette jaugée et placée dans une fiole jaugée de 1,00 L contenant au
2/3 d'eau distillée. Compléter avec de l'eau distillée jusqu'au trait
de jauge. Agiter pour rendre homogène.
le graphe pH = f(v) obtenu lors de la simulation du dosage de 20,0 mL
de la solution obtenue par une solution d'hydroxyde de sodium de
concentration molaire 0,20 mol/L est donné.
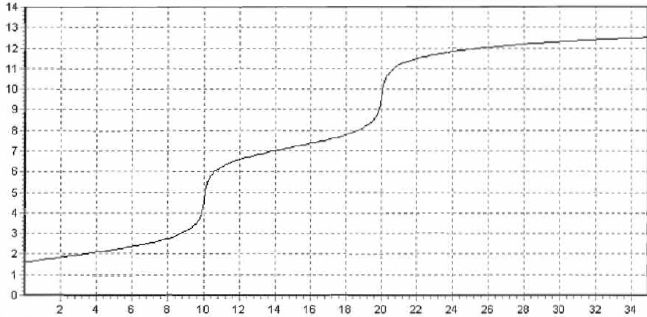
Ecrire les équations de la réaction correspondant à chacune des parties de la courbes.
De 0 à 10 mL : H3PO4aq + HO-aq = H2PO4-aq + H2O(l).
De 10 à 20 mL : H2PO4-aq+ HO-aq = HPO42-aq + H2O(l).
Pourquoi n'observe-t-on que deux sauts de pH alors que l'acide phosphorique est un triacide ?
HPO42-aq + HO-aq = PO43-aq + H2O(l).
La troisième acidité est trop faible pour être dosée : la transformation n'est pas totale à l'équivalence.
Pourquoi faut-il étalonner les solutions de soude destinées aux titrages acido-basiques des acides faibles ?
Le dioxyde de carbone de l'atmosphère est soluble dans l'eau. Il réagit
avec les ions hydroxyde. La solution de soude est carbonatée et sa
concentration change.
Quel est le rôle de chaque électrode utilisée pour un dosage pHmétrique ? Quelle est l'opération préalable à un titrage pH-métrique ?
L'électrode de verre, électrode de mesure est sensible à la
concentration aux ions oxonium ; l'autre électrode sert de référence.
L'électrode combinée mesure Everre - Eréférence
et traduit cette différence en unité pH grâce à l'étalonnage préalable
à partir de deux solutions tampon étalon à températaure donnée.
|
.
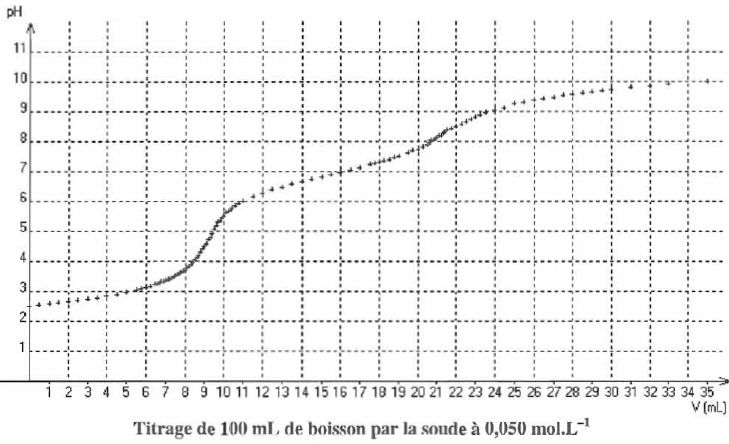
En exploitant le premier saut de pH ( Véq = 9,4 mL ), évaluer la concentration en acide phosphorique dans la boisson.
Si seul l'acide phosphorique est dosé : H3PO4aq + HO-aq = H2PO4-aq + H2O(l).
A l'équivalence n(H3PO4aq) = n(HO-aq) = 0,050*9,4 = 0,47 mmol dans 100 mL de boisson titrée.
[acide phosphorique ] = 0,47 / 100 = 4,7 10-3 mol/L.
Si seul l'acide phosphorique était dosé, quelle valeur atteindrait-on pour la seconde équivalence ?
2*9,4 = 18,8 mL.
Si le dégazage a été effectué de manière à atteindre l'équilibre thermodynamique à 298 K, quelle influence quantitative a la présence de CO2 aq sur les volumes aux équivalences ?
nCO2aq étant très faible, sa présence n'aurait aucune influence.
Obtention d'acide phosphorique en TP.
Dans
un becher de 600 mL, introduire 300 mL d'acide sulfurique à 0,5 mol/L
et ajouter petit à petit sous agitation 15,5 g de phosphate
tricalcique. Après une quinzaine de minutes, filtrer, récupérer fe
filtrat et le laver à l'eau distillée. Sécher à l'étuve à 50 °C pendant
30 min et peser.
Prélever 50 mL de filtrat précédent et diluer 10 fois. A l'aide des
indicateurs hélianthine et phénolphtaléine, réaliser les dosages
concordants de 20,0 mL de la solution obtenue par la soude à 0,100
mol/L.
Expérimentalement, le précipité est un solide blanc et les volumes obtenus aux équivalences lors des dosages sont Véq1 = 8,6 mL pour le virage de l'hélianthine et Véq2 = 14,4 mL pour le virage de la phénolphtaléine.
Lors du dosage, écrire le(s) équation(s) de la réaction traduisant la transformation jusqu'au virage de l'hélianthine.
Le phosphate tricalcique et en défaut et l'acide sulfurique en excès.
On dose donc les deux acidités de l'acide sulfurique en excès et la
première acidité de l'acide phosphorique au virage de l'hélianthine :
H2SO4aq + HO-aq = HSO4-aq + H2O(l).
HSO4-aq + HO-aq = SO42-aq + H2O(l).
H3PO4aq + HO-aq = H2PO4-aq + H2O(l).
On définit le rendement en acide comme la quantité de matière d'ion H+ produite rapporté à la quantité de matière de H+ initial : h = 3 nH3PO4 formé / (2 nH2SO4 initial).
Montrer
que la quantité d'acide sulfurique de départ n'a pas besoin d'être
connue précisément pour évaluer le rendement défini. Calculer ce
rendement.
A la première équivalence, virage de l'hélianthine : 2 nH2SO4 dosé + nH3PO4 = Véq1 CHO-.
Entre les deux équivalences, la transformation est modélisée par : H2PO4-aq+ HO-aq = HPO42-aq + H2O(l).
nH3PO4 = (Véq2-Véq1 ) CHO-.
Ca3PO4(s) + 3H2SO4aq = 2H3PO4aq + 3Ca2SO4(s). nH2SO4 réagi = 1,5 nH3PO4 ;
nH2SO4 initial = nH2SO4 dosé + 1,5 nH3PO4 =½Véq1 CHO- - ½nH3PO4 + 1,5 nH3PO4 =½Véq1 CHO-+ nH3PO4 ;
nH2SO4 initial =½Véq1 CHO-+ (Véq2-Véq1 ) CHO- =CHO-(Véq2 -0,5Véq1).
2nH2SO4 initial =CHO-(2Véq2 -Véq1).
h = 3(Véq2-Véq1 ) / (2Véq2 -Véq1) = 3(14,4-8,6) / (28,8-8,6) =17,4 / 20,2 =0,86.
|
.
|

