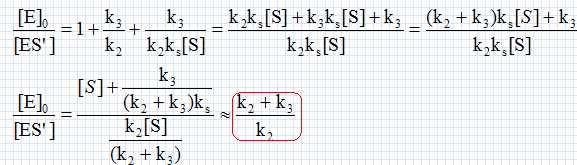|
Raffinage électrolytique de l'étain ; ressources animales marines : concours Capes 2012. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||
| .
. |
||||||
|
||||||
|
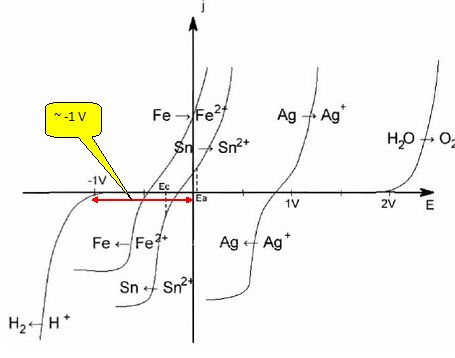
Le raffinage électrolytique de l'étain consiste à placer l'étain impur à l'anode d'une cellule d'électrolyse, et une plaque d'étain ultra pur à la cathode. Les deux électrodes plongent dans un électrolyte à pH = 0 contenant du sulfate stanneux ( Sn2+, SO42- ). La différence de potentiel appliquée entre les deux électrodes est 0,3 V et la densité du courant est 100 A m-2.
La surtension est de l'ordre de -1 V. Un tel système est "lent". Le rendement en courant de l'opération de raffinage étant de l'ordre de 88 %, calculer la masse d'étain qui se dépose sur une plaque d'étain de dimension 2 m sur 3 m, pendant une durée de 15 min. Intensité I = 100*2*3 = 600 A ; tenir compte du rendement : 600*0,88 = 528 A. Quantité d'électricité Q = It = 528*15*60 =4,752 105 C. Quantité de matière d'électrons : n(e-) = Q / 96500 = 4,924 mol. Sn2+ +2e- = Sn(s) : n(Sn) = ½n(e-) =0,5 *4,924 =2,462 mol. Masse d'étain déposée : m = n (Sn) M(Sn) = 2,462 *118,7 =2,9 102 g. Certaines impuretés peuvent former, lors de l'électrolyse, une couche qui adhère à l'anode et la passive. Ceci entraîne une surtension Expliquer le terme passivation. Le dépôt d'impuretés constitue une couche imperméable : l'anode d'étain est alors protégé ( passivé) par cette couche.
Les ressources animales marines. Le dépeçage des poissons comme le thon est une opération difficile qui peut être rendue plus aisée grâce à des enzymes: les peptidases. Placé dans un bain tiède d'un mélange de peptidases pendant quelques minutes, la peau peut être retirée presque intégralement avec de simples jets d'eau. La papaïne E est une peptidase dont l'action sur le substrat S peut être modélisée par le schéma suivant : Formation d'un complexe enzyme-substrat ES ; équilibre rapide établi, constante d'équilibre ks : E+S = ES ; ks = [ES] /([E][S]. (0) Etape de constante de vitesse k2 : ES --> ES' +P1. Etape de constante de vitesse k3 : ES' --> E +P2. Donner les principales caractéristiques d'un catalyseur. Un catalyseur augmente la vitesse d'une réaction lente. Il est régénéré à la fin et n'apparaît pas dans le bilan. Si deux issues sont possibles, il peut orienter la réaction vers l'une d'elle. Donner la vitesse v de formation de P2 en fonction des constantes de vitesse ki et de certaines concentrations. v = k3[ES']. Appliquer l'approximation des états quasi-stationnaires à l'espèce ES'. En déduire une relation entre les concentrations en ES, ES' et les constantes de vitesse k2 et k3. d[ES']/dt =0 = - k3[ES']+k2[ES] (1) Ecrire la conservation de la matière pour l'enzyme E. On note [E]0 la cencentration totale de l'enzyme sous toutes ces formes. [E]0 =[E]+[ES]+[ES']. (2) Montrer que la vitesse v peut se mettre sous la forme v = A[S] / (B +[S] où A et B sont des constantes qui dépendent de k2, k3, ks, [E]0 et C0. Donner les expressions de A et B. (1) s'écrit : [ES]=k3 / k2 [ES'] ; repport dans (2) : [E]0 =[E]+(1+k3 / k2)[ES']. (3) (0) s'écrit : [E] = [ES] /(ks[S] ) =k3 [ES']/ (k2 ks[S]) ; repport dans (3) : [E]0 =(k3 / (k2 ks[S])+1+k3 / k2)[ES'] ; [ES'] = [E]0 / (k3 / (k2 ks[S])+1+k3 / k2). Par suite : 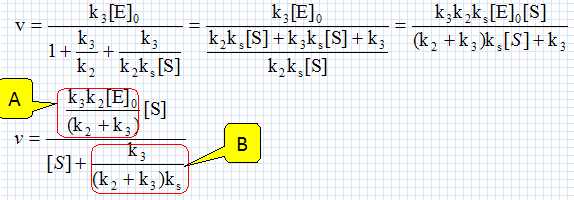
|
||||||
|
|