|
Connaissances de base, quantité de matière, dosage acide base : concours ATRF préparateur en chimie Maine 2011. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Compléter et équilibrer les réactions chimiques suivantes. (COOH)2 + 2 NaOH → (COO-)2 + 2Na+ + 2 H2O. H3BO3 +2 H2O → B(OH)4- + H3O+. H3PO4 + 3 NaOH → PO43- + 3Na+ + 3 H2O. I2 + 2 S2O32- → 2 I- + S4O62-. 6 Fe2+ + Cr2O72- + 14 H3O+ → 6 Fe3+ + 2 Cr3+ +21 H2O. Ca2+ + 2 Cl- → CaCl2. Pb2+ + 2I- →PbI2. Monographie en chimie organique: précisez la fonction principale de la molécule et donnez son nom :
Equilibrez cette réaction : Ag+aq + Cl-aq ---> AgCl(s). Donnez le nom de la réaction et le nom du produit formé. Précipitation du chlorure d'argent. Par quelle méthode peut-on récupérer le produit formé ? Filtration. La réaction d’aluminothermie consiste à faire réagir l’aluminium métal sur un oxyde, par exemple l’oxyde de fer (III) Fe2O3. Écrire l’équation bilan de la réaction sachant qu’il se forme de l’oxyde d’aluminium Al2O3 et du fer métal. 2Al + Fe2O3 ---> Al2O3 + 2Fe. On désire obtenir m=500 g de fer. Calculer les masses d’aluminium et d’oxyde de fer (III) qu’il va falloir faire entrer en réaction. Quantité de matière de fer n(Fe) = m / M(Fe) = 500/56 = 8,9286 mol Quantité de matière d'aluminium n(Al) = n(Fe) = 8,9286 mol Quantité de matière d'oxyde de fer (III) : n(Fe2O3) = 0,5 n(Fe) =0,5*8,9286 =4,4643 mol. Masse d'aluminium : m(Al) = n(Al) M(Al) = 8,9286 *27 =241,0 ~2,4 102 g. Masse d'oxyde de fer(III) : M(Fe2O3) = 2*56+3*16 = 160 g/mol. Masse d'oxyde de fer(III) : n(Fe2O3) M(Fe2O3) =4,4643*160 =714,3 ~7,1 102 g. Quelle est la masse d’oxyde d’aluminium formé ? La loi de Lavoisier est-elle vérifiée ? Quantité de matière d'oxyde d'aluminium : n(Al2O3) = 0,5 n(Al) =0,5*8,9286 =4,4643 mol. Masse d'oxyde d'aluminium : M(Al2O3) = 2*27+3*16 = 102 g/mol. Masse d'oxyde d'aluminium : n(Al2O3) M(Al2O3) =4,4643*102 =455,4 ~4,5 102 g. La masse des réactifs est égale à celle des produits : la loi de lavoisier est vérifiée. Masses atomiques molaires en g.mol-1 : M(O) = 16 ; M(Al) = 27 ; M(Fe) = 56. Pour fabriquer du chlorure d’hydrogène, on fait réagir du dichlore avec du dihydrogène. Écrire l’équation bilan de la réaction. H2(g) + Cl2(g) = 2HCl(g). Quels volumes de dihydrogène et de dichlore faut-il faire réagir pour obtenir 24 m3 de chlorure d’hydrogène ? (tous les volumes sont mesurés dans les mêmes conditions). Les volumes des gaz sont proportionnels aux nombres stoechiométriques de l'équation, c'est à dire 1, 1 et 2. Don 12 m3 de dihydrogène et 12 m3 de dichlore. Quels volumes de dihydrogène et de dichlore fait-il pour obtenir une tonne de chlorure d’hydrogène ? Vm = 24 L/mol ; M(HCl) = 36,5 g/mol ; M(H) = 1,0 g/mol. Quantité de matière de chlorure d'hydrogène : n (HCl) =1,0 106 / 36,5 = 2,74 104 mol. n(H2) = n(Cl2) = ½n(HCl) = 1,37 104 mol. V(H2) = V(Cl2) = n(Cl2) Vm =1,37 104 *24 =3,3 105 L.
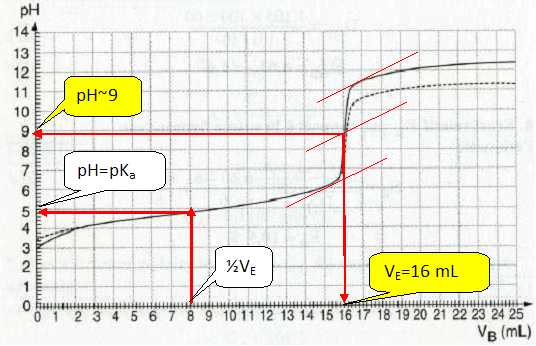
Calculer la concentration de l’acide éthanoïque. A l'équivalence CA VA = CB VE ; CA = CB VE / VA= 0,1 * 16 / 20 = 8,0 10-2 mol/L. Indiquer le point de la courbe pour lequel on a CH3CO2H = CH3CO2- . Comment nomme-ton ce point ? Le mélange correspondant à ce point possède des propriétés. Lesquelles ? A la demi-équivalence, pH = pKa. La solution est une solution tampon. Celle-ci modère les variations de pH due à l'ajout modéré d'acide ou de base ainsi qu'à une dilution modérée. On dilue, au dixième, la solution d’acide éthanoïque et on fait de même pour la solution de soude. On dose 20 mL de la solution d’acide éthanoïque diluée par la solution de soude diluée. On obtient alors la courbe en pointillés sur le même graphe (pour les seuls points où elle diffère de la courbe précédente). Il est visible, sur le graphe, que le volume de soude à l’équivalence n’a pas changé. Expliquer. La dilution est faite en ajoutant de l'eau distillée : celle-ci n'apporte quasiment pas d'ion oxonium H3O+aq. En s’aidant de la courbe, estimer de combien a varié le pH initial de la solution d’acide éthanoïque. Dans les mêmes conditions de dilution, quelle aurait été la variation de pH avec un acide fort ? Lecture du pH initial : en diluant au 1/10è une solution d'acide éthanoïque, le pH augmente d'environ 0,4 unité pH. En diluant 10 fois une solution d'acide chlorhydrique, le pH varierait d'une unité pH. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||