Un exemple de chimie verte, la synthèse de l'ibuprofène, bac S Antilles
09/2013.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
..
|
|
|
|
|
Partie 1 : description de l'ibuprofène.
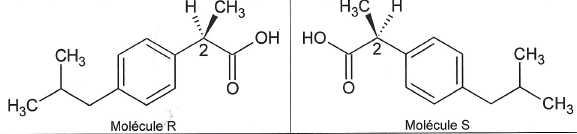
La molécule d'ibuprofène possède deux stéréoisomères, notés R et S, représentés ci-dessous :
Quel est le nom du groupe caractéristique oxygéné que comporte l'ibuprofène ? Quelle est la fonction chimique correspondante ?
La molécule d'ibuprofène possède un groupe carboxyle -COOH : cette molécule possède une fonction acide carboxylique.
Quel qualificatif utilise-t-on pour désigner le carbone n°2 sur les représeentations ci-dessus ?
Le carbone n°2, relié à 4 atomes ou groupes d'atomes différents est asymétrique.
Les molécules R et S sont-elles identiques, énantiomères ou diastéréoisomères ? Justifier.
Les deux molécules R et S sont images l'une de l'autre dans un miroir : elles constituent un couple d'énantiomères.
Partie 2 : analyse des voies de synthèse.
L'indicateur
de l'efficacité d'un procédé est l'utilisation atomique (UA), définie
comme le rapport de la masse molaire du produit recherché sur la somme
des masses molaires de tous les produits qui apparaissent dans
l'équation stoechiométrique ( ou par la somme des masses molaires de
tous les réactifs ).
L'utilisation atomique du procédé des laboratoires Boots est UA1 = 0,40 et celui du procédé de la société BHC vaut environ UA2=0,77. Conclure.
Le
procédé de la société BHC est plus efficace, la quantité de
sous-produit est considérablement réduite. La pollution à la source est
réduite et le procédé est plus respectueux de l'environnement. De plus
l'unique sous-produit est valorisé.
Procédés Boots et BHC.
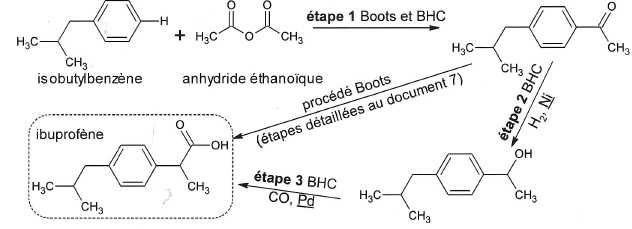
Les espèces soulignées Ni et Pd ( étapes 2 et 3 ) ne sont ps des réactifs.
De quels types d'espèces s'agit-il ? Quel est leur rôle ?
Ni et Pd jouent le rôle de catalyseurs : ils accélèrent la réaction chimique.
|
| .
. |
|
|
L'étape
1 des procédés Boots et BHC est identique. Il y a formation du composé
représenté et d'acide éthanoïque, non représenté. S'agit-il d'une addition, élimination ou d'une substitution ?
Il s'agit d'une substitution sur le noyau benzénique. Un atome d'hydrogène du noyau benzénique est remplacé par le groupe CO-CH3.
Procédé Boots : étapes 2 à 6.
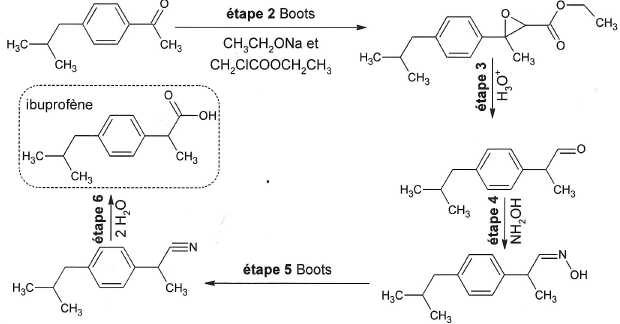
A quelle grande catégorie de réactions l'étape 5 du procédé Boots appartient-elle ?.
Elimination d'une molécule d'eau. La double liaison C=N est remplacée par une liaison triple carbone azote.
|
.
|
|
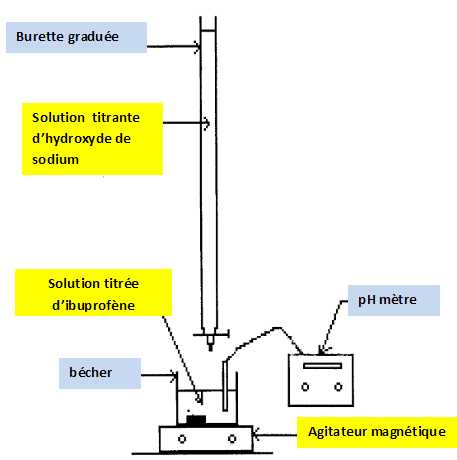
Partie 3 : titrage d'un comprimé d'ibuprofène.
Afin de réaliser le titrage de l'ibuprofène contenu dans un comprimé d'"ibuprofène 400 mg" :
- on réduit en poudre le comprimé dans un mortier à l'aide d'un pilon ;
-
on sépare la molécule active des excipients par dissolution dans
l'éthanol que l'on évapore ensuite ( les excipients sont insolubles
dans l'éthanol ) ;
- on introduit la poudre obtenue dans un becher et on ajoute environ 40 mL d'eau distillée ;
- le titrage est effectué à l'aide d'une burette graduée contenant une solution aqueuse d'hydroxyde de sodium ( Na+aq + HO-aq) de concentration molaire apportée cb =0,20 mol/L. Le titrage est suivi par pHmétrie. Réaliser un schéma du montage permettant d'effectuer le titrage.
Définir l'équivalence d'un titrage.
A
l'équivalence les réactifs sont en proportions stoechiométriques. Avant
l'équivalence, l'un des réactifs est en escès, après l'équivalence,
l'autre réactif est en excès.
On rentre dans un tableur -grapheur les différentes valeurs du pH mesurées en fonction du volume vb de solution d'hydroxyde de sodium ajoutée. On utilise les fonctionnalités du tableur pour dériver le pH par rapport à vb, la grandeur obtenue est notée dpH / dVb.
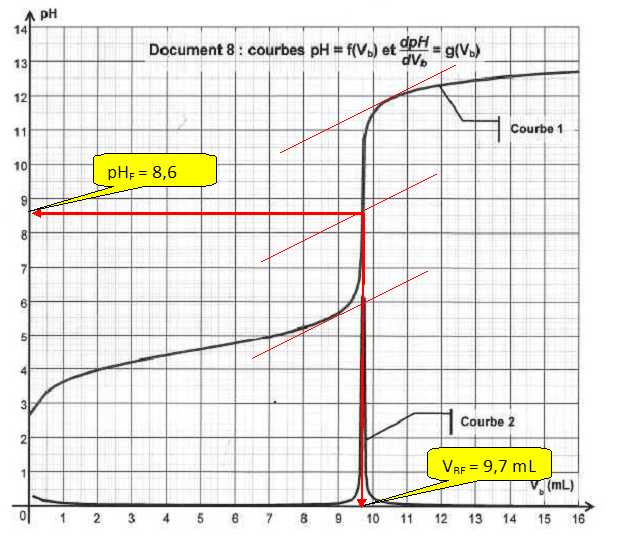
Parmi les courbes 1 et 2 , quelle est celle qui représente pH = f(vb) et celle qui représente dpH/dvb = g(vb) ?
Courbe 1 : pH = f(vb) ; courbe 2 : dpH/dvb = g(vb).
Déterminer la valeur du volume équivalent par une méthode de votre choix.
Méthode des tangentes ( voir ci-dessus) ou bien la courbe dpH/dvb = g(vb) présente un maximum à l'équivalence.
|
On note à présent l'ibuprofène R-COOH.
A quel couple acide / base appartient l'ion HO- ?
L'ion hydroxyde HO- est la base du couple acide / base H2O / HO-.
Ecrire l'équation de la réaction support du titrage.
RCOOH aq + HO-aq ---> RCOO-aq + H2O(l).
Quelles caractéristiques doit posséder une réaction chimique pour être utilisée lors d'un titrage ?
La réaction chimique doit être totale et rapide.
Le pKa du couple auquel appartient l'ibuprofène est pKa = 4,5 à 25°C.
Placer sur un diagramme les domaines de prédominance des espèces du couple RCOOH / RCOO-.
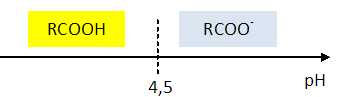
Déterminer quelle espèce prédomine en début du titrage ?
Le pH initial est voisin de 2,8 : à pH inférieur au pKa la forme acide RCOOH prédomine.
La solution d'hydroxyde de sodium est initialement placée dans la burette.
Calculer
le pH de cette solution aqueuse dans l'hypothèse d'une solution diluée.
Quelle précautions d'utilisation convient-il de prendre ? Justifier.
pH = 14 + log cb = 14 + log 0,2 = 13,3.
La solution est caustique et corrosive : port de blouse, lunette de protection et gants.
Déterminer la quantité d'ion hydroxyde nE(HO-) versée à l'équivalence et en déduire la quantité de matière n(ibu) d'ibuprofène titré.
n(ibu)=nE(HO-)= cb VBE = 0,20 *9,7 10-3 =1,94 10-3 ~1,9 10-3 mol.
En déduire la masse m d'ibuprofène titré et la comparer à la valeur attendue. M(ibuprofène) = 206 g/mol.
m =n(ibu) M(ibuprofène) =1,94 10-3 *206 =0,399 ~0,40 g, en accord avec la valeur attendue " 400 mg".
On
souhaite évaleur l'incertitude U(m) sur la masse m liée aux différentes
sources d'erreurs avec un niveau de confiance de 95 %. Dans ces
conditions :
- l'incertitude sur la mesure du volume versé par cette burette est Uvol =0,16 mL ;
- l'incertitude sur la concentration en hydroxyde de sodium est Ucb =0,010 mol/L.
L'incertitude U(m) sur la masse est alors telle que : U(m)/m = [(Uvol/VBE)2 +(Ucb/cb)2 ]½.
Présenter le résultat de la valeur de la masse sous la forme m = m ±U(m).
U(m) = [(0,16 / 9,7)2 +(0,010 / 0,20)2 ]½= 5,3 10-2 g.
m =( 0,40 ± 5,3 10-2 ) g.
Parmi
les indicateurs colorés acido-basiques proposés, quel est celui qui est
le mieux adapté au titrage précédent ? Justifier.
Vert de bromocrésol : jaune ; 3,8 -5,4 ; bleu.
Phénolphtaléine : incolore ; 8,2 - 10 ; rose.
Jaune d'alizarine : jaune ; 10,1 - 12,0 ; rouge -orangé.
La zone de virage de l'indicateur coloré doit contenir le pH de l'équivalence ( 8,6 ) : la phénolphtaléine convient.
|
|
|