|
|
Acide-base
; réactions acido-basiques.
le sang est une solution tampon dont le pH est maintenu à environ 7,4
grâce à la présence d'acide carbonique de formule H2CO3
et de sa base conjuguée, l'ion hydrogénocarbonate HCO3-.
La concentration molaire en ion hydrogénocarbonate dans le sang est
habituellement comprise entre 2,2 10-2 mol/L et
2,6 10-2 mol/L.
Si la concentration en ions hydrogénocarbonate pase en dessous de 2,2 10-2
mol/L, un patient peut présenter les symptômes d'une aidose étabolique,
qui est un trouble de l'équilibre acido-basique défini par une baisse
du pH du sang.
Rappeler
quelles sont les propriétés d'une solution tampon.
Une solution
tampon modère les variations de pH suite à l'ajoiut modéré d'une base
ou d'un acide, suite à une dilution modérée.
L'acide carbonique est un acide faible.
Définir
un acide faible.
Un acide faible
réagit partiellement avec l'eau.
L'équation de la réaction entre l'acide carbonique et l'eau est la
suivante :
H2CO3 + H2O
= HCO3- + H3O+.
Donner
l'expression de la constante d'acidité Ka du
couple : H2CO3
/ HCO3-
.
Ka = [HCO3-][H3O+] / [H2CO3].
La valeur du pKa
du couple H2CO3
/ HCO3-
est 6,37.
Indiquer
quelle forme acide ou basique de ce couple prédomine dans un sang de
pH=7,4. Justifier.
A pH supérieur à pKa, la forme base HCO3-
prédomine.
Un opérateur prépare une solution S d'hydrogénocarbonate de sodium de
concentration correspondant à celle du sang. Avant de l'utiliser, il
procède à un titrage pH-métrique des ions hydrogénocarbonate de
cette solution par une solution d'acide chlorhydrique afin
d'en vérifier la concentration.
Il prélève un volume Vb = 10,0 mL de la
solution S de concentration cb en ion
hydrogénocarbonate à vérifier.
Il verse progressivement dans ces 10,0 mL de solution, un volume Va
d'acide chlorhydrique de concentration ca = 2,0
10-2 mol/L et mesure régulièrement le pH du
mélange réactionnel.
Légender
le schéma du dispositif expérimental. Utiliser entre
autres les termes de solution titrée et de solution titrante.
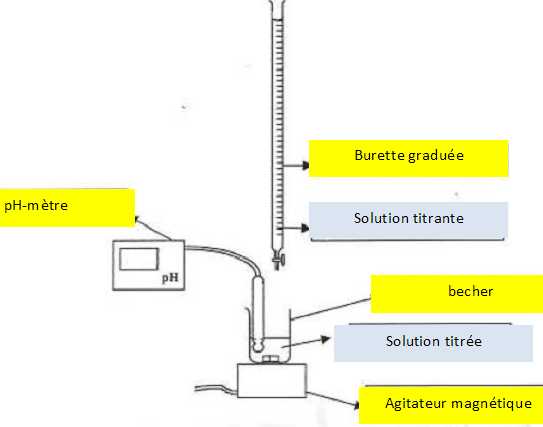
|
.
Définir
l'équivalence du titrage.
A
l'équivalence les quantités de matière des réactifs sont en proportions
stoechiométriques. Avant l'équivalence, l'un des réactifs est
en
excès, après l'équivalence, l'autre réactif est en excès.
Déterminer
graphiquement le volume VAE qu'il a fallu verser
à l'équivalence.
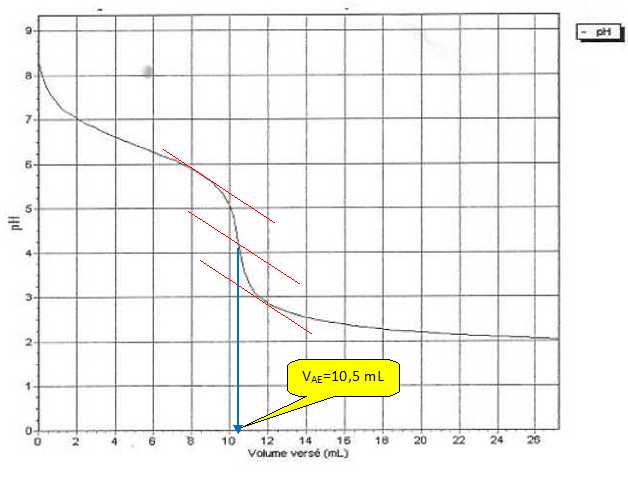
L'équation de la réaction du titrage
est : HCO3-
+ H3O+ ---> H2CO3
+ H2O.
Etablir
l'expression littérale de la concentration cb.
A l'équivalence : Vb cb
= VAE ca ; cb
= VAE ca / Vb.
En déduire
que cb = 2,1 10-2
mol/L
cb
= VAE
ca / Vb = 10,5*2,0 10-2
/ 10,0 = 2,1 10-2 mol/L.
Si
une telle concentration était mesurée dans le sang d'un patient
pourrait-on penser que celui-ci est en situation d'acidose métabolique
? Justifier.
Si la
concentration en ions hydrogénocarbonate pase en dessous de 2,2 10-2
mol/L, un patient peut présenter les symptômes d'une aidose étabolique.
C'est donc le cas de ce patient.
|
.
|

