|
Aspirine.
L'acide acétylsalicylique, plus connu sous le nom d'aspirine, est
utilisé pour soulager la douleur, faire baisser la fièvre et diminuer
les inflammations. À ce titre, dans les milieux sportifs, l’aspirine
sert souvent à combattre les douleurs musculaires. On désire vérifier
l’indication « Aspirine 500 mg » portée sur l’emballage d’un comprimé
d’aspirine.
On dissout dans un premier temps ce comprimé d’aspirine finement broyé
dans de l’eau distillée afin d’obtenir un volume V = 200 mL de solution.
On prélève avec précision un volume Va = 20,0 mL de cette
solution.
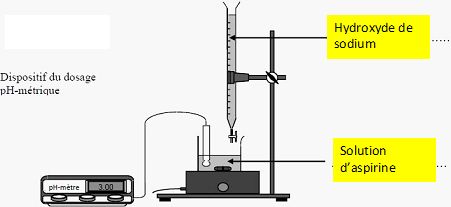
Choisir
le matériel qu’il faut utiliser pour effectuer le prélèvement parmi la
liste ci-dessous :
- bécher de 200 mL, éprouvette graduée de 250 mL, fiole jaugée de 200
mL, pipette jaugée de 20,0 mL, propipette (ou poire à pipeter), spatule.
Un volume précis est prélevé à l'aide d'une pipette jaugée de 20,0 mL
surmontée d'un poire à pipeter.
On dose par pH-métrie le volume Va = 20,0 mL de la solution
prélevée avec une solution aqueuse d’hydroxyde de sodium (Na+
+ HO-) de concentration molaire Cb = 2,0 x 10-2
mol.L-1.
Compléter
ce schéma en indiquant où se trouve :
- la solution aqueuse d’aspirine, - la solution aqueuse d’hydroxyde de
sodium.
L’acide acétylsalicylique (ou aspirine) sera noté AH.
L’équation de la réaction acido-basique qui a lieu au cours du dosage
entre l’aspirine AH et l’ion hydroxyde HO- est :
AH + HO- ---> A- + H2O.
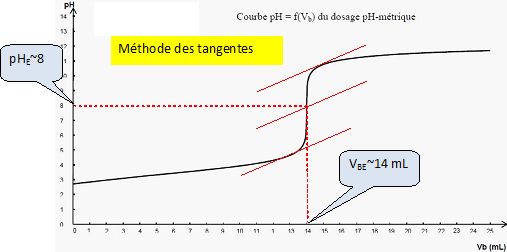
On obtient la courbe représentant le pH en fonction du volume Vb
de solution aqueuse d’hydroxyde de sodium versé.
Faire
apparaître la méthode graphique permettant de déterminer le volume VBE versé à
l’équivalence. Vérifier que VBE = 14,0 mL.
Donner
la relation à l’équivalence entre la quantité de matière na
d’aspirine (AH) dosée et la quantité de matière nbE d’ions hydroxyde (HO-) introduite à
l’équivalence.
Les quantités de matière d'aspirine et d'ion hydroxyde sont en
proportions stoechiométriques à l'équivalence : na = nbE.
Déduire
de la question précédente la relation entre les grandeurs Ca, Cb, Va et VBE. Ca
est la concentration molaire en aspirine de la solution dosée.
CaVa = CbVBE.
Montrer
que la concentration molaire en aspirine de la solution dosée est
: Ca = 1,4 x 10-2 mol.L-1.
Ca
= CbVBE /Va = 2,0 10-2
*14/20 =1,4 10-2 mol/L.
Vérifier
que la quantité de matière nasp d’aspirine (AH)
dans la solution titrée est égale à nasp = 2,8 x 10-3 mol.
nasp = CaVa =1,4 10-2 *0,20
=2,8 10-3 mol.
En
déduire la masse masp d’aspirine du
comprimé sachant que la masse molaire de l’aspirine est Masp
= 180 g.mol-1.
masp = 180 *2,8 10-3 =0,504 ~0,50 g . Ce qui est
conforme à l'indication " aspirine 500 mg".
|