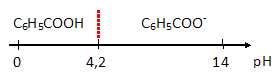|
|
| acide benzoïque | benzoate de sodium | | formule semi-développée | C6H5-COOH | C6H5-COO- Na+. | | masse molaire ( g/mol) | 122 | 144 | | solubilité dans l'eau | très peu soluble s = 2,4 g/L | très soluble s = 650 g/L. |
pKa(C6H5-COOH / C6H5-COO-) = 4,2.
Etude d'un soda.
L'étiquette indique la présence du conservateur E 210, qui est le code européen de l'acide benzoïque.
Sur une échelle de pH représenter les domaines de prédominance de l'acide benzoïque et de l'ion benzoate.
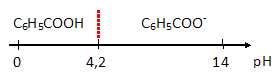
Le pH de cette boisson vaut 3.
Quel est le constituant du couple (C6H5-COOH / C6H5-COO-) qui est majoritaire ?
A pH inférieur à pKa, la forme acide (C6H5-COOH / C6H5-COO-) est majoritaire.
Donner l'expression littérale du rapport [C6H5-COO-] / [C6H5-COOH] ?
pH = pKa + log ([C6H5-COO-] / [C6H5-COOH]) ;
[C6H5-COO-] / [C6H5-COOH] = 10 (pH-pKa) = 10-1,2 = 0,063.
[C6H5-COOH] =[C6H5-COO-] /0,063 ~16 [C6H5-COO-] ; l'acide benzoïque est bien majoritaire à pH=3.
Etude d'une solution d'acide benzoïque.
On prépare une solution aqueuse d'acide benzoïque notée S1, de concentration c1 = 1,0 10-2 mol/L.
La solution S1 est-elle saturée ?
Solubilité de l'acide benzoïque s = 2,4 / 122 = 1,97 10-2 ~2,0 10-2 mol/L.
c1 < s, la solution n'est pas saturée.
Ecrire l'équation chimique de la réaction de l'acide benzoïque avec l'eau.
C6H5-COOH + H2O = C6H5-COO- + H3O+.
Etablir l'expression du pH puis le calculer. Commenter le résultat.
| avancement volumique (mol/L) | C6H5-COOH | + H2O | = C6H5-COO- | + H3O+ | | initial | 0 | c1 | solvant
large
excès | 0 | 0 | | en cours | x | c1-x | x | x | | équilibre | X =xéq | c1-X | X | X |
Ka =[C6H5-COO-]éq[H3O+]éq / [C6H5-COOH]éq =X2 / (c1-X)
10-4,2 = 6,3 10-5 = X2 / (0,01-X) ; 6,3 10-5 (0,01-X) = X2 ;
X2 + 6,3 10-5 X - 6,3 10-7=0 ; D = 2,52 10-6 ; X = 7,63 10-4 mol/L.
pH = -log(7,63 10-4) = 3,1.
Le pH est bien supérieur à -log c1 : l'acide benzoïque est un acide faible qui réagit partiellement avec l'eau.
|
| .
. |
.
.
Etude d'une solution de benzoate de sodium.
On dispose d'une solution aqueuse de benzoate de sodium notée S2. On y ajoute un peu d'acide chlorhydrique concentré ( H3O+ + Cl- ) de telle sorte que l'acide chlorhydrique soit en défaut par rapport au benzoate de sodium. Un précipité blanc apparaît.
Ecrire l'équation de la réaction.
H3O+ +C6H5-COO- = C6H5-COOH+ H2O.
Exprimer la constante d'équilibre K associée à cette réaction en fonction de Ka.
K = [C6H5-COOH]éq /([C6H5-COO-]éq[H3O+]éq ) = 1/Ka.
Calculer sa valeur et conclure.
K = 1 /(6,3 10-5) =1,6 104.
K étant très grande, l'ion benzoate réagit totalement avec l'ion oxonium.
Nommer le produit solide obtenu et interpréter sa formation.
Il se forme de l'acide benzoïque très peu soluble dans l'eau. Ce dernier précipite.
On filtre la solution et on mesure son pH. celui-ci vaut 4,2.
Quelle propriété possède la solution filtrée ? Justifier.
A pH = pKa, [C6H5-COO-]éq = [C6H5-COOH]éq.
On obtient une solution tampon, celle-ci modère les variations de pH
suite à l'ajout modéré d'acide ou de base forte, suite à une dilution
modérée.
|
.
|