|
|
L'azote représente environ 3 % de la masse du corps humain,
ce qui en fait le quatrième élément en masse par ordre d'abondance
après l'oxygène, le carbone et l'hydrogène. On le retrouve dans les
molécules biologiques fondamentales pour les êtres vivants : acides
aminés, bases azotées, protèines, acides nucléiques, ADN, ARN...
Les acides a-aminés.
Les acides a-aminés possèdent un groupe acide carboxylique et un groupe amine en position a par rapport au premier.
A partir de combien d'acides a-aminés différents sont formées les protéines humaines ?
Il suffit de 20 acides aminés pour construire toutes les protèines humaines.
Pourquoi certains acides a-aminés sont qualifiés d'essentiels ?
les acides a-aminés essentiels ne peuvent pas être synthétisés par le corps humain et doivent être apportés par l'alimentation.
La glutamine existe essentiellement sous forme d'amphion (ou zwittérion ). On donne à 25 °C, les pKa des couples de la glutamine : 2,2 et 9,1.
Tracer un diagramme de prédominance des différentes formes acido-basique de la glutamine en fonction du pH.
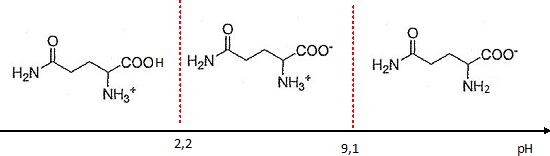
On rappelle que le point isoélectrique est le pH pour lequel la forme zwittérionique est maximale.
Déterminer le point isoélectrique de la glutamine.
pH = ½(pKa1 + pKa2) = 0,5 (2,2 + 9,1) ~5,7.
Liaison peptidique.
Les protéines sont formées d'un enchaînement bien défni d'acides a-aminés.
Ces derniers sont associés par une liaison peptidique. Par exemple, la
formation d'un dipeptide par la réaction entre les deux acides a-aminés, alanine et glutamine, peut être modélisée par l'équation :
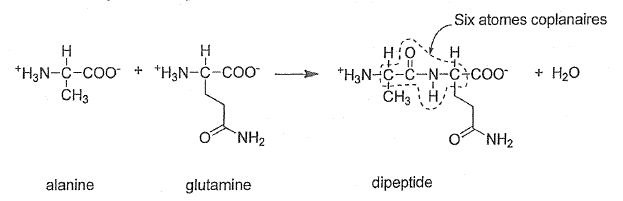
|
.
La
liaison peptidique possède une géométrie fixe, il n'y a pas de rotation
autour de la liaison C-N créée. Les atomes C, O, N, H de la liaison
peptidique et les deux atomes de carbone voisins sont situés dans un
même plan et les angles de liaison autour des atomes de carbone de C=O
et l'azote sont d'environ 120°. De plus, un dipeptide peut adopter deux
configurations : cis ou trans.
Proposer
une justification permettant d'interpréter la rigidité de la liaison
peptidique et le fait que les six atomes mentionnés soient coplanaires.
L'oxygène
est plus électronégatif que l'azote : les électrons délocalisés de la
liaison peptidique sont plus proches de l'oxygène et cette liaison est
polaire.
La longueur de cette liaison est 133 pm, valeur intermédiaire entre une liaison simple C-N et une liaison double C=N.
Ce caractère de liaison partiellement double empèche la rotation autour de la liaison C N.
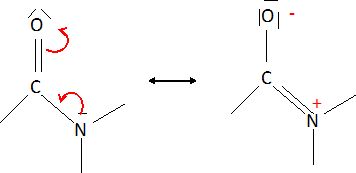
Le groupe peptidique est donc confiné dans un plan. L'encombrement stérique est ainsi minimisé.
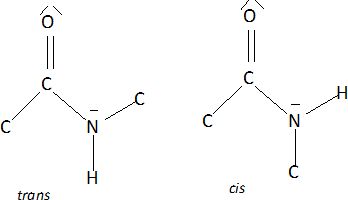
Dessiner la structure de chacune des deux cofigurations cis et trans du dipeptide. ( en se limitant aux six atomes sus-nommés).
La synthèse du dipeptide proposé ne peut
pas être effectuée directement avec un bon rendement. Une méthode de
synthèse automatisée, sur support solide, permet de synthétiser
efficacement des polypeptides depuis le début des années 1960.
Expliquer pourquoi la synthèse directe du dipeptide ne peut pas être effectuée avec un bon rendement.
A
partir de deux acides aminées alanine ( Ala) et de la glutamine ( Glu)
on peut obtenir 4 dipeptides : Ala - Ala ; Glu - Glu ; Ala - Glu et Glu
- Ala.
Proposer une stratégie de synthèse plus efficace du dipeptide. ( sans expliciter chacune des étapes ).
Il faut bloquer de façon permanente les fonctions réactives éventuellement portées par les groupes R1 et R2.
Il faut savoir enlever ces groupements protecteurs des fonctions
latérales avec un rendement proche de 100 %. Cette déprotection
s'effectue en fin de synthèse, lors de la séparation du peptide du
support solide.
Il faut également bloquer la fonction amine de l'un des acides a-aminés et le groupe acide carboxylique de l'autre acide a-aminé.
Il faut activer ( par formation d'un ester ) la fonction carboxyle COOH qui doit réagir.
Donner les avantages de la synthèse sur matrice solide.
Le
dipeptide est ancré sur la phase solide, un simple lavage élimine les
réactifs restés en solution. Les étapes de purification sont supprimées.
On peut utiliser un excès de réactifs ( ces derniers pouvant être
éliminés par lavage ), le produit désiré restant sur la phase solide
jusqu'à la fin de la synthèse.
La myoglobine est une protéine de synthèse constituée d'un enchaînement ordonné de 153 acides anminés.
Combien
de protéines différentes comportant 153 acides aminés peut-on obtenir à
partir d'un mélange constitué de 20 acides aminés différents ?
20153 = 1,14 10199.
Indiquer
très succinctement comment la synthèse d'une protèine telle que la
myoglobine s'opère dans un organisme vivant pour n'obtenir que cette
seule protèine plutôt qu'un mélange.
Transcription : la séquence d'ADN codant le gène associé à la protéine
est transcrite en ARN messager ( ARNm). L'un des brins d'ADN sert de
matrice.
Traduction : dans le ribosome, l'information apportée par l'ARNm
est décodée. L'ARNm est traduit en protéine. Les ARN de transfet
peuvent servir de "traducteurs".
|
.



