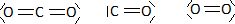Entretion de la
chaudière : chimie.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Étude de la
mise en place d’un adoucisseur d’eau en amont.
Le document suivant présente une situation d’évaluation proposée aux
élèves au cours de la classe de terminale.
Définir
la dureté de l’eau. Définir le titre
hydrotimétrique total d’une eau.
La dureté d'une eau est donnée par la concentration totale en ions
calcium et en ions magnésium. On définit le titre hydrotimétrique (°TH)
par : 1° TH = 10-4 mol/L d'ion calcium et magnésium. A
partir de 25°TH, l'eau est qualifiée de dure. Il est admis qu'une
dureté comprise entre 15 et 20 degrés français est idéale.
L'utilisation d'une eau trop dure provoque l'entartrage des
canalisations et est néfaste à la santé.
Proposer
un protocole expérimental permettant de vérifier si l'adoucisseur d'eau
joue bien son rôle.
On dispose de deux échantillons d'eau A : eau prélevée avant
l'adoucisseur ; B : eau prélevée après l'adoucisseur.
Dans un tube à essai on verse 2 mL de l'eau A, puis quelques gouttes de
réactif d'identification des ions calcium, l'oxalate d'ammonium : on
observe un précipité blanc.
Dans
un tube à essai on verse 2 mL de l'eau A, puis quelques gouttes de
réactif d'identification des ions magnésium, le jaune de thiazole : on
observe un précipité rouge.
Faire de même avec l'échantillon B: si l'adoucisseur est bien réglé, on
ne doit pas observer de précipités.
Pour déterminer la dureté de l'eau adoucie ( eau B), on réalise un
dosage colorimétrique. L'indicateur d'équivalence utilisé est le NET.
Dans les conditions de l'expérimentation, à l'équivalence, on considère
que 1degré français correspond à 1 mL d'EDTA ajouté.
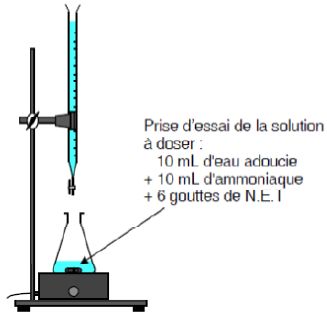
Estimer
l'encadrement du volume d'EDTA versé attendu à l'équivalence dans le
cas d'une eau dure idéale.
Il est admis qu'une dureté comprise entre 15 et
20 degrés français est idéale. Le volume d'EDTA est donc compris entre
15 et 20 mL.
|
|
|
A
propos du désembouage.
Préciser
le type de réaction chimique que subit le métal lors de sa corrosion.
Lors de la corrosion un métal s'oxyde.
Citer
trois facteurs qui favorisent la corrosion.
Le dioxygène de l'air, l'humidité, la présence d'un milieu marin
conducteur ( ions sodium ), la réalisation d'une pile électrochimique
en présence d'un autre métal..
Parmi les moyens de protection d’un métal contre la corrosion on
utilise par exemple la passivation d’un métal par l’acide nitrique
fumant. Expliquer
le principe de la protection d’un métal par passivation.
Le métal est recouvert d'un film artificiel ou naturel qui ralenti la
vitesse de corrosion. Bien souvent ( aluminium, acier inoxydable,
titane) ce film apparaît spontanément par oxydation : l'oxyde formé est
insoluble, protecteur du métal.
Le tartre est essentiellement constitué de carbonate de calcium solide
de formule CaCO3(s).
Déterminer
la solubilité du carbonate de calcium dans l’eau à 25°C, en considérant
que les espèces dissoutes n’ont pas de propriétés acido-basiques
particulières. Détailler le raisonnement en s’appuyant sur un
tableau d’avancement. On donne pKs(CaCO3) = 8,4 à
25°C.
|
avancement
volumique (mol / L)
|
CaCO3(s)
|
--->
Ca2+aq
|
+CO32-aq
|
Etat
initial
|
0
|
n
|
0
|
0
|
en
cours
|
x
|
n-x
|
x
|
x
|
Etat
final
|
xf
|
n-xf
|
xf |
xf |
Ks = [Ca2+aq]éq
[CO32-aq]éq = xf2.
xf = 10-4,2 = 6,3 10-5 mol/L.
En considérant maintenant les propriétés acido-basiques des ions
carbonate CO32-aq dans
l’eau, prévoir
par un raisonnement qualitatif si la valeur réelle de la solubilité est
supérieure, égale ou inférieure à celle déterminée précédemment.
CO32- aq + H2O = HCO3-aq
+ HO-aq.
L'équilibre CaCO3(s) = Ca2+aq + CO32-aq
est déplacé dans le sens direct. La solubilité croît.
|
.
|
|
À propos des
gaz d’échappement et des condensats.
Les gaz d’échappement, dont le dioxyde de carbone produit par la
combustion, se dissolvent dans l’eau des condensats. Ainsi une partie
du dioxyde de carbone gazeux produit par la chaudière n’est pas évacuée
dans l’atmosphère mais est dissoute dans l’eau des condensats.
Le graphe suivant présente le diagramme de distribution des espèces
acido-basiques issues du dioxyde de carbone dissous (CO2, H2O)
en fonction du pH, les valeurs de pKa des couples en jeu
étant :
pKa1 (CO2,H2O / HCO3-)
= 6,4 et pKa2
( HCO3-/ CO32-) = 10,3.
Expliquer
en quoi le piégeage du dioxyde de carbone dans les condensats est
intéressant.
Le dioxyde de carbone est un gaz à effet de serre ; il contribue au
réchauffement climatique. Moins on en rejette, plus on lutte contre cet
effet de serre.
Attribuer
aux trois courbes du diagramme les différentes espèces en jeu.
Retrouver les valeurs des pKa associés aux
couples concernés. Justifier la réponse.
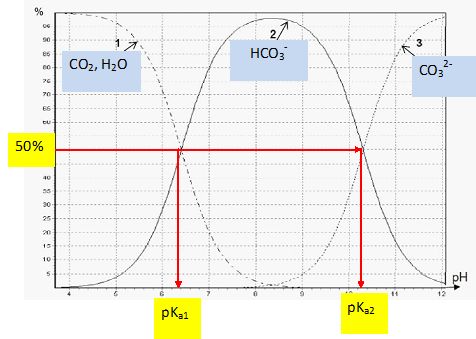
A pH = pKa, les formes acide et base d'un couple acide/base
ont la même concentration.
Calculer
le pH d’une eau exempte de toute espèce dissoute à l’exception du
dioxyde de carbone, sachant que la concentration de dioxyde de
carbone (CO2, H2O) est constante et vaut C0
= 7,0.10-5 mol.L-1. On détaillera le raisonnement
et on vérifiera la validité des approximations effectuées.
On fait l'hypothèse que le pH est très inférieur à 10,3 : dans ce cas
l'ion carbonate est négligeable devant les autres espèces.
Ka1 = [HCO3-][H3O+]
/ [CO2,
H2O].
La solution est électriquement neutre : [HCO3-]=[H3O+]
= (Ka1c0)½
=(10-6,4 *7,0 10-5)½ =5,3 10-6
mol/L ; pH = -log(5,3 10-6) =5,3.
L'hypothèse formulée est bien vérifiée.
L’acidité
des condensats peut porter atteinte aux canalisations en fonte (alliage
de fer et de carbone). Expliquer à l’aide
de l’équation d’une réaction chimique.
Fe(s) + 2H3O+aq
---> Fe2+aq + H2(g) + 2H2O.
Il est
recommandé d’utiliser des filtres neutralisants qui diminuent l’acidité
des condensats avant leur évacuation vers les eaux usées dans les
égouts. Les filtres neutralisants sur le marché contiennent de la
Calcite et du Corosex. La Calcite est un sable qui contient du
carbonate de calcium et le Corosex est un oxyde de magnésium. Estimer si le
Corosex est une base plus forte ou plus faible que la Calcite.
L'oxyde de magnésium MgO est une base bien plus forte que l'ion
carbonate.
|
Mesure de la
teneur en monoxyde de carbone.
En France, l’entretien annuel de son installation de chauffage et de
production d’eau chaude est obligatoire. La visite d’entretien par un
professionnel comporte une liste d’opérations à effectuer, comme la
mesure de la teneur en différents gaz selon le type de chaudière
(dioxyde de carbone, monoxyde de carbone, dioxygène, etc.).
Donner
la formule de Lewis des trois gaz cités précédemment (CO2,
CO et O2).
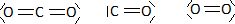
Préciser
en quoi il est important de mesurer la teneur en monoxyde de carbone.
Le monoxyde de carbone est un gaz incolore, inodore, asphyxiant.
Schéma de principe d'un capteur électrochimique de détection du CO.
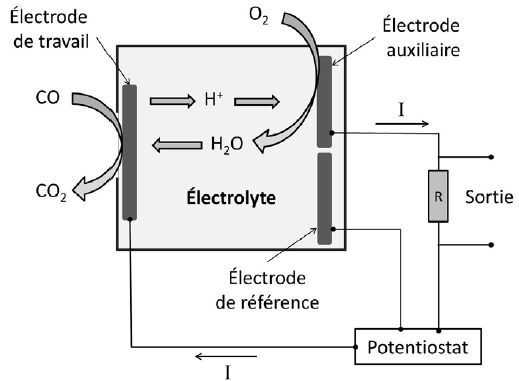
Écrire
la demi-équation électronique pour le couple CO2/CO à l’électrode de
travail. Préciser de quel type d’électrode (anode ou cathode) il s’agit.
Oxydation du CO en CO2 à l'anode : CO((g) +H2O(l)=
CO2(g)+2H+aq + 2e-.
Écrire
la demi-équation électronique pour le couple O2/H2O à l’électrode
auxiliaire. Préciser de quel type d’électrode (anode ou cathode) il
s’agit.
Réduction de O2 en H2O à la cathode : ½O2(g)
+2H+aq
+ 2e-
= H2O(l)
En
déduire l’équation de la réaction de fonctionnement de ce capteur
électrochimique.
CO((g)
+½O2(g)
=CO2(g).
Expliquer en quoi ce
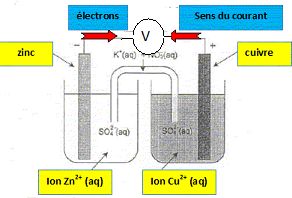
capteur est assimilable à une pile électrochimique.
Ce capteur est constitué de deux électrodes différentes en contact avec
un électrolyte. Des électrons sont libérés à l'anode ( où se produit
une oxydation ), traverse le circuit extérieur ( potentiostat, R) et
gagne la cathode positive ( où se produit une réduction ).
|
|
|