|
|
|
|
Préparation
d'un organomagnésien.
On
introduit dans un ballon tricol 6 g de magnésium, de l'éther anhydre
pour recouvrir, puis on ajoute goutte à gutte une solution étherée
contenant 13,6 g de bromoéthane. L'addition terminée, la solution
magnésienne est portée à reflux 30 minutes, puis refroidie jusqu'à
température ambiante. le volume final V est de 30 mL.
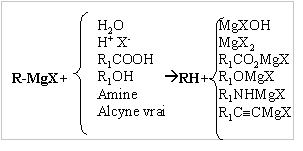
Donner
l'équation générale de réaction d'un organomagnésien en précisant sur
quelle fonction il réagi.

Donner
l'équation de formation de l'organomagnésien étudié ci-dessus.
CH3-CH2Br + Mg -->
CH3-CH2MgBr.
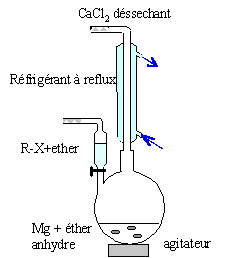
Quelles
précations doit-on prendre pour :
- effectuer cette synthèse ( milieu, montage, vererie utilisée,
atmosphère, solvant).
|
Colonne Vigeux ou réfrigérant droit surmonté
d'un dispositif déshydratant contenant CaCl2.
ampoule de coulée ; ajout goutte à goutte du
dérivé bromé
ballon bicol contenant de l'éther anhydre et
les copeaux de magnésium
Dispositif d'agitation.
Il faut
travailler en milieu anhydre, sinon l'organomagnésien est détruit par
l'eau ( la réaction est vive); de plus l'éther, par ses propriétés
basiques, stabilise l'organomagnésien formé.
L'éther est un produit inflammable : travailler en absence de flamme.
|
-
Donner deux réactions parasites justifiant ces explications.
réaction
de couplage de Wurtz.
RBr + RMgBr = R-R + MgBr2.
On l'évite en ajoutant goutte à goutte le dérivé bromé et en utilisant
le magnésium en excès.
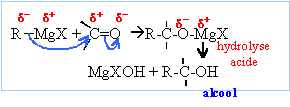
Les
organomagnésiens sont des bases fortes : en présence d'eau ils
s'hydrolysent suivant :
RMgBr
+ H2O --> RH +
½MgBr2 + ½Mg(OH)2.
-Indiquer
une méthode pour obtenir de l'éther éthylique anhydre.
Utiliser un déshydratantt : MgSO4
anhydre, Na2SO4 anhydre.
- Pourquoi faut-til utiliser un solvant éthéré pour préparer un réactif
de Grignard ?
L'organomagnésien
est une base forte susceptible de réagir avec les solvants protiques :
éthanol, acide éthanoïque, éthylamine sont donc exclus.
Le solvant,
une base de Lewis, doit stabiliser l'organomagnésien : cychlohexane
exclu.
Un
organomagnésien réagit avec les dérivés chlorés : HCCl3 exclu.
L'éther, par ses propriétés basiques,
stabilise l'organomagnésien formé. Le solvant doit
être assez polaire pour dissoudre l'organomagnésien.
Dosage
du magnésien.
Pour
ce dosage 1 mL de solution d'organomagnésien est prélevée et versée
dans 10 mL d'une solution de diiode dans le benzène à 0,25 mol/L.
l'iode en excès est dosé par une solution de thiosulfate de sodium 0,1
mol/L. La décoloration de la solution benzénique de diiode est obtenue
après ajout de 17 mL de thiosulfate.
Ecrire
l'équation de réaction de l'organomagnésien sur le diiode.
RMgX + I2 -->R I + ½MgX2
+ ½MgI2.
Ecrire
l'équation de réaction des ions thiosulfates sur le diiode.
I2 + 2S2O32-
--> 2I- + S4O62-.
Calculer
le nombre de mole d'organomagnésien contenu dans le volume V. En
déduire le rendement de cette étape.
n(S2O32-
)
=17 10-3 *0,1 =1,7 10-3
mol ; n(I2)excès
=½n(S2O32-
)
=8,5 10-4 mol.
n(I2)initial
=0,25*10 10-3 =2,5 10-3
mol.
n(I2) réagissant avec le magnésien : 2,5
10-3 -8,5
10-4 =1,65 10-3 mol.
n(magnésien) = 1,65
10-3 mol dans 1 mL soit dans 30 mL : 30*1,65 10-3
= 4,95 10-2 mol.
On
introduit dans un ballon tricol 6 g de magnésium, de l'éther anhydre
pour recouvrir, puis on ajoute goutte à gutte une solution étherée
contenant 13,6 g de bromoéthane.
n(Mg)initial =6 / 24,31 =0,247 mol ;
n(bromoéthane )initial =13,6 / (79,90 +24+5)
=0,125 mol.
On peut espérer obtenir au mieux 0,125 mol de magnésien.
Rendement : 4,95 10-2 / 0,125 =0,16.
|
.
|
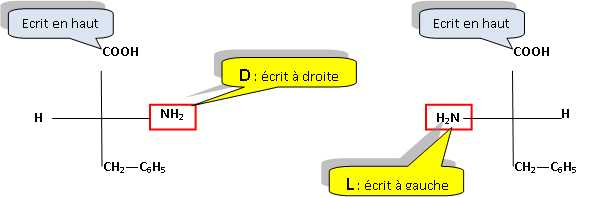
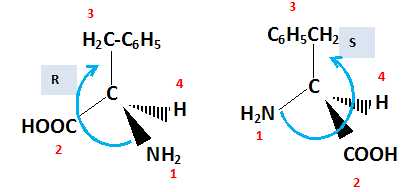
Stéréochimie.
La phénylalanine est un acide aminé de formule C6H5-CH2-CH(NH2)-COOH.
Donner les
représentations D et L de Fisher et R et Sselon Cram pour cette molécule.
Synthèse
et séparation.
Soit la réaction suivante :
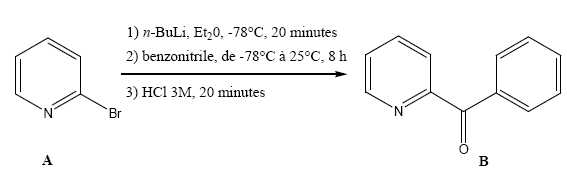
Donner
la formule développée du benzonitrile.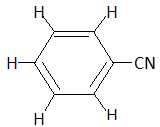
Donner la
nomenclature IUPAC du composé A et de la cétone B.
2-bromopyridine
; 1-phényl.-3-pyridyl propanone.
Donner
la structure de tous les intermédiaires réactionnels entre A et B, en
précisant le mécanisme de leur formation.
Substitution électrophile sur la 2-bromopyridine : 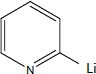
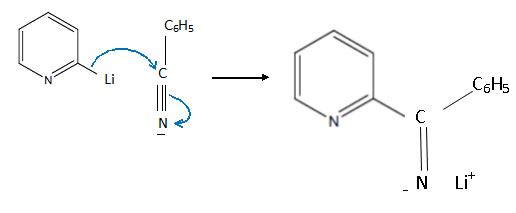
Suivie d'une hydrolyse du sel.
|
|
L'avancement de la réaction est
suivi par chromatographie sur couche mince ( CCM) sur gel de silice, en
utilisant une mélange cyclohexane / acétate d'éthyle comme éluant.
Décrire
brièvement la technique mise en jeu ( mise en oeuvre et
principe).
But : séparer et identifier les
constituants d'un mélange.
Mise en oeuvre
: placer l'éluant dans le bécher ( hauteur 5 mm), mettre un couvercle.
Sur la plaque CCM, tracer 2 traits au crayon de papier à 7 ou 8 mm des
extrémités.
Sur le trait inférieur faire les dépots (pipette pasteur), espèces à
analyser et substances étalon.
Placer la plaque dans le bécher, fermer, retirer dés que l'éluant
atteint le trait supérieur.
De
quel solvant faut-il augmenter la proportion pour passer du
chromatogramme A aux chromatogrammes B, C et D.
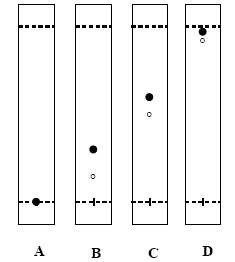
Le gel de silice est polaire ; la molécule B est très peu polaire, elle
a une affinité pour un solvant apolaire. Il faut ajouter
davantage de cyclohexane à l'éluant.
Transposition de la CCM à la purification sur colone de silice "flash"
du produit de la réaction. Le produit de la réaction correspond à la
tache noire.
Quelles
sont les conditions chromatographiques optimles ( A-D) pour la
purification du produit de la réaction sur colonne de silice "flash"?
Elle utilise des particules de silice de 35 à 70 m et le solvant s’écoule sous pression d’air comprimé.
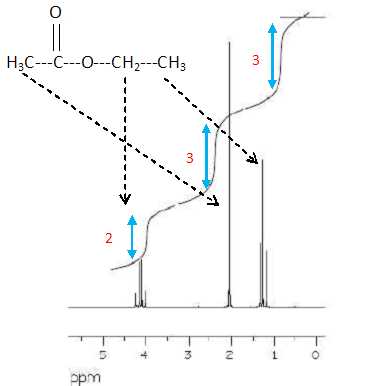
Après purification, le produit de la réaction est analysé par
RMN du proton ( 90 MHz, CDCl3). Le spectre joint
ci-dessous ( agrandissement de la zone comprise entre 0 et 5,5 ppm)
montre que le produit n'est pas sec.
En
justifiant, préciser la nature du (des) solvant(s) résiduel(s).
|
|