|
|
|
|
Les acides organiques du vin tels que l'acide tartrique et l'acide malique peuvent être dosés par HPLC.
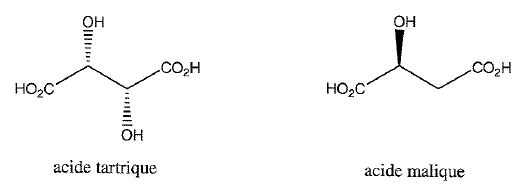
Donner leurs noms en nomenclature officielle ?
Acide 2, 3-dihydroxybutane-1,4-dioïque ; acide 2-hydroxybutane-1,4-dioïque
Ces
composés possèdent-ils des carbones asymétriques ? Si oui, notez sur
les structures ci-dessous et préciser leur(s) configuration(s).
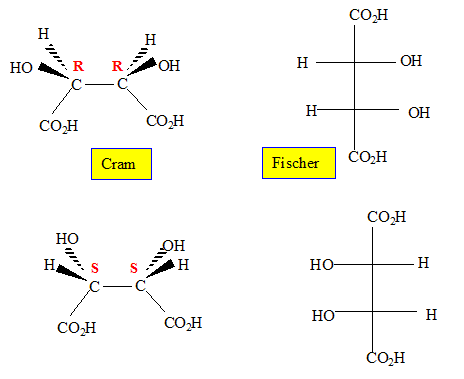
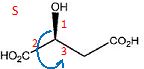
Ces composés sont-ils optiquement actifs ?
Ces composés ne possédant aucun élément de symétrie sont optiquement actifs.
|
.
|
Ces composés sont analysés en HPLC dans les conditions suivantes : colonne C18, 5µm, 250 x 4, éluant eau à 0,2 % de H3PO4, débit 0,7 mL min-1, boucle d'injection 10 µL, détection UV 210 nm. On observe deux pics 1 et 2 de temps de rétention t1 = 3,5 min et t2 = 4,2 min et de largeur de pic de base w1 = 0,15 min et w2 =0,16 min.
Que signifie le terme C18 ?
Les groupes alkyles greffés sur la phase stationnaire comptent 18 atomes de
carbone.
S'agit-il d'une chromatographie d'adsorption ou de partage ? Justifier.
La chromatographie de partage :
Elle est basée sur la
différence de solubilité du soluté dans la phase mobile et la phase
stationnaire
C'est une
chromatographie liquide-liquide. La phase stationnaire est un liquide fixé sur
un support inerte. Cette chromatographie est ainsi dénommée car elle est basée
sur le partage du soluté dans les deux phases liquides .
Il s'agit d'une chromatographie d'adsorption
:
C'est une chromatographie liquide-solide. La phase stationnaire est un
adsorbant solide polaire.
- La chromatographie d'adsorption en phase inverse
:
C'est une chromatographie liquide-solide dans laquelle la phase
stationnaire est apolaire.
Pourquoi met-on de l'acide dans l'éluant ?
En milieu basique,
l'acide carboxylique serait en partie sous forme d'ion carboxylate.Le milieu acide évite cette
réaction.
Attribuer à l'acide tartrique et à l'acide malique leurs temps de rétention. Justifier l'ordre d'élution.
La phase stationnaire est apolaire ; la phase mobile est polaire : les espèces
les plus polaires migrent le plus vite.
Dans l'ordre, du plus rapide au
moins rapide : acide tartrique ( t1 = 3,5 min), acide malique ( t2 = 4,2 min).
A quoi est due l'absorbance à 210 nm ?
Doublet électronique libre de l'oxygène ; transition n - s*.
Afin de juger l'efficacité de l'analyse, vous devez déterminer le nombre de plateaux théoriques N.
Quelle formule allez-vous utiliser ? Calculez N et H ( hauteur équivalente à un plateau théorique ) pour l'acide tartrique.
N = 5,54 (t /w½)2 = 16(t /w0)2 = avec t : temps de rétention et w½ : largeur du pic à mi-hauteur ; largeur de la base du pic w0 = 1,7 w½ si le pic est gaussien.
N = 16 (3,5 / 0,15)2 ~8,7 103.
H = L/N avec L longueur de la colonne. Pour une colonne de longueur 1 m, H = 1,1 10-4 m.
Afin de quantifier ces deux acides dans différents échantillons, on se propose de réaliser un étalonnage.
Quel type d'étalonnage préconisez-vous ? Justifiez et décrivez la réalétalonnage.
L'aire d'un pic est proportionnelle à la concentration ou à la quantité de produit analysé. Le volume injecté sera constant.
On compare la réponse du ou des produits à analyser à celle d'un étalon interne.
Méthode de l'étalon interne : une solution étalon est préparée avec le
ou les produits que l'on veut doser. Dans l'échantillon contenant les
masses m1, m2... de solutés, on ajoute me de l'étalon.
|
Si
vous devez comparer deux conditions d'analyse différentes, la plus
efficace est-elle celle qui donne le plus grand ou le plus petit nombre
de plateaux ?
Plus le pic est fin,plus le nombre de plateaux théorique est grand et plus la chromatographie est efficace.
Comment déterminer expérimentalement le temps mort de cette analyse ?
Le temps mort tm
est le temps mis par un composé non retenu par la phase stationnaire
pour traverser la colonne (temps passé uniquement dans la phase mobile).
Injecter un produit non retenu par la colonne.
D'autres acides sont présents dans le vin. L'acidité totale d'un vin
est la somme des acides titrables, quand on amène le vin à pH =7 par
addition d'une solution de soude. L'acide carbonique n'est pas compris
dans l'acidité totale. Comment éliminer l'acide carbonique du vin ?
Porter le vin à ébulition pendant quelques minutes. Le dioxyde de carbone dissous se dégage.
L'acidité totale doit être exprimée en gramme d'acide tartrique par
litre de vin. Le dosage de 5 mL de vin par la soude NaOH à 0,1 mol/L en
présence de BBT donne un volume de 9 mL.
Exprimer l'acidité totale du vin en g/L d'acide tartrique.
n(soude) = 0,1 *9 = 0,9 mmol.
L'acide tartrique est un diacide : n( acide tartrique) = ½n(soude) = 0,45 mmol dans 5 mL de vin soit 0,45/5 =0,09 mol/L.
M( acide tartrique ) = 4*12+6+6*16 = 150 g/mol soit 0,09*150 =13,5 g/L.
Parmi les acides carboxyliques ci-dessous, quel composé présente l'acidité la plus forte ? La moins forte ? Justifier en faisant appel aux effets électroniques.
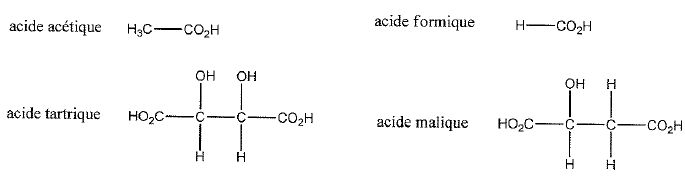
L'acide est d'autant plus fort que l'hydrogène du goupe OH est plus mobile, plus appauvri en électrons.
OH est attracteur d'électrons, CH3 est donneur d'électrons, par suite l'acide tartrique est le pus fort, l'acide acétique le plus faible.
Vous ne disposez pas d'une colonne C18, mais d'une colonne de silice pour effectuer cette analyse.
Proposez une modification chimique des acides malique et tartrique pour leur analyse sur colonne de silice.
La colonne de silice est polaire ; l'éluant sera apolaire ; estérifier
les fonctions acide carboxylique de l'acide tartrique et de
l'acide malique.
|
|



