|
Méthodes
de dosage du dioxygène. Agrégation 2004
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
|
|
|
|
|
|
|
Dosage
de l’oxygène dissous par la méthode de Winkler.
Cette méthode, mise au point par Winkler en 1888, est aujourd’hui
encore très utilisée pour l’analyse des eaux ou l’étalonnage des sondes
oxymétriques.
Protocole adapté des Olympiades de chimie : remplir à ras bord d’'eau
distillée un erlenmeyer de 250 mL contenant 7 pastilles de soude et 2 g
de chlorure de manganèse (II). Boucher rapidement l’'erlenmeyer en
évitant de maintenir de l’'air à l’intérieur. Agiter jusqu’à
dissolution complète des réactifs et attendre environ 30 minutes. On
observe un précipité brun. Verser le contenu de l’'erlenmeyer dans un
bécher contenant de l’'acide sulfurique concentré et 3 g d'’iodure de
potassium. Homogénéiser, agiter jusqu’à persistance de la seule couleur
jaune limpide, le précipité brun disparaissant totalement. Prélever 100
mL de la solution et la doser avec une solution de thiosulfate de
sodium à 1,25×10-2 mol.L-1.
Étude
du diagramme potentiel-pH simplifié du manganèse.
Ce diagramme est établi pour les formes suivantes, intervenant dans la
méthode de Winkler : Mn2+, Mn3+,
Mn(OH)2, Mn2O3
hydraté que l’on notera Mn(OH)3. La convention
de tracé utilisée est la suivante : les espèces dissoutes contenant le
manganèse ont une concentration totale de 0,10 mol.L-1
et, sur une frontière, seules les deux formes du couple sont
considérées. Sur le graphe sont tracées en pointillés les frontières
correspondant aux couples O2/H2O
et I2/I -.
Donner
la configuration électronique du manganèse. Quel est le degré
d’oxydation maximal possible pour l’élément manganèse ?
Z = 25 ; 1s2 2s2 2p6
3s2 3p6 4s2
3d5soit encore [Ar]4s2 3d5.
Le degré d'oxydation maximal possible du
manganèse est égal à VII.
Attribuer,
en le justifiant, les différents domaines du diagramme aux espèces
concernées en précisant s’il s’agit de domaines d’existence ou de
prédominance.
Les domaines d'existence concernent les solides ; les domaines de
prédominance concernent les ions.
Les domaines sont attribués en classant les espèces suivant
leur degré d'oxydation et selon le pH.
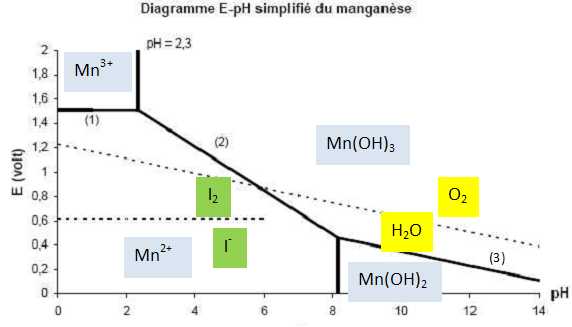
Calculer
la pente de la frontière (2).
Mn 2+aq +3H 2O = Mn(OH) 3(s)
+3H +aq+ e -.
E = E°( Mn(OH)3(s)/Mn2+aq)
+0,06 log ([ H+aq] 3/ ([Mn2+aq]).
E = E°(Mn(OH)3(s)/Mn2+aq)
-0,06 log[Mn2+aq]
+0,06*3log ([H+aq]).
E = E°(Mn(OH)3(s)/Mn2+aq)
-0,06 log[Mn2+aq] -0,18 pH. Pente :-0,18 par unité pH.
Déterminer
le produit de solubilité Ks de Mn(OH)3.
Ks = [Mn3+aq][HO-aq]3.
[Mn3+aq]
=0,10 mol/L ; [HO-aq]
=10-14/10-pH= 10-14+2,3
=2,0 10-12 mol/L.
Ks = 0,10 * (2,0 10-12)3=8,0
10-37.
Quelles
frontières seraient modifiées si l’on changeait la
concentration totale ?
Les frontières verticales et la frontière (2) seront modifiées.
Analyse du protocole.
Pourquoi
faut-il se placer initialement en milieu basique ? Quelle est la nature
du précipité brun formé
?
Mn2+ et O2 appartiennent
à des domaines disjoints uniquement en milieu basique. L'oxydation de Mn2+
par le dioxygène conduit à Mn(OH)3.
Écrire
l’équation de la réaction d’oxydo-réduction qui se déroule. Pourquoi
doit-on attendre 30 minutes ?
½O2 +H2O +2e-=
2HO- ; 2Mn2+
+6HO- =2Mn(OH)3 +2e-.
2Mn2+
+6HO- +½O2 +H2O +2e-=2Mn(OH)3 +2e-+ 2HO-.
2Mn2+
+ ½O2 +4HO- +H2O --->
2Mn(OH)3. La transformation est lente, il faut
donc attendre 30 minutes.
Écrire
les équations des réactions qui se produisent lors du passage en milieu
acide et de l’ajout d’iodure de potassium.
Dissolution de Mn(OH)3 : Mn(OH)3(s)
+ 3H+aq = Mn3+aq + 3H2O.
Oxydation de l'ion iodure en diiode : 2I-aq +2Mn3+aq = I2aq
+2 Mn2+aq.
Pourquoi
l’iodure de potassium est-il ajouté en large excès ?
En présence d'un excès d'iodure de potassium, on solubilise
le diode sous la forme d'ion triiodure I3-.
Écrire
l’équation de la réaction de titrage. Déterminer la concentration du
dioxygène en mg.L-1 sachant
que le volume de thiosulfate de sodium versé, pour une eau saturée en O2 à 25°C,
est V = 8,2 mL.
2S 2O 32-aq
+ I 2aq = S 4O 62-aq
+ 2I -aq.
n( I2aq)
= ½n( S2O32-aq)
=0,5 *8,2 10 -3 *1,25 10 -2
=5,125 10 -5 mol.
1 O 2 ---> 4 Mn(OH)3 --->
4 Mn3+--->2 I2.
n( Mn3+aq)
= 2 n(I2aq)
=1,025
10-4 mol ; n(O2) = 0,25 n(Mn3+aq)=
2,56 10-5 mol dans 100 mL d'eau.
2,56 10-5
*10 = 2,56 10-4
mol O2 par litre ou : 32*2,56 10-4
= 8,2 10-3 g/L ~ 8,2 mg/L.
|
| .
. |
|
|
Le tableau
suivant donne l’évolution de la concentration de O2
dans l’eau, à saturation, en fonction de la température. En déduire,
moyennant une approximation que l’on précisera, l’enthalpie standard de
réaction ΔrH°
de dissolution du dioxygène dans l’eau. On considèrera que la pression
partielle de dioxygène vaut 0,20 bar.
| [O2]
en mmol/L |
0,442 |
0,341 |
0,305 |
0,276 |
0,230 |
0,219 |
| T(°C) |
0 |
10 |
15 |
20 |
30 |
35 |
| 1/T ( K-1) |
0,00366 |
0,00353 |
0,00347 |
0,00341 |
0,00330 |
0,00325 |
| K° |
0,00221 |
0,001705 |
0,001525 |
0,00138 |
0,00115 |
0,0011 |
| ln K° |
-6,11 |
-6,37 |
-6,49 |
-6,59 |
-6,77 |
-6,82 |
O2(g) = O2
aq avecK° = [O2
aq ]P°/(C° PO2)=
[O2
aq ]/PO2.
Loi de Van't Hoff : dln K°/dT =DrH°/(RT2).
Intégrer en supposant DrH°
constant sur l'intervalle de température : ln K°
(T)-lnK°(T0) = -DrH°/R
[1/T-1/T0].
On trace ln K° en fonction de 1/T : le coefficient directeur de la
droite vaut -DrH°/R
= 1,74 103.
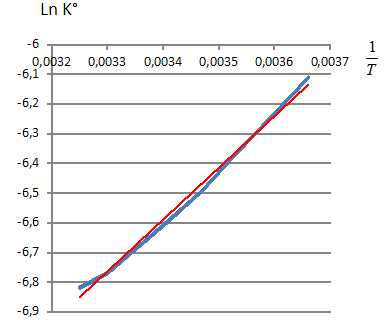 DrH°
= -1,74 103*8,31 = -1,45 103
kJ/mol. DrH°
= -1,74 103*8,31 = -1,45 103
kJ/mol.
L’électrode
de Clark.
Cette sonde est très utilisée en biologie pour la mesure des teneurs en
dioxygène. Sa miniaturisation permet même son emploi in-vivo.
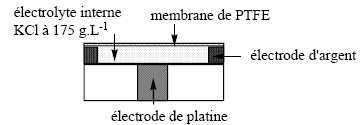
La concentration en dioxygène dissous est déterminée par électrolyse de
la solution contenue dans la cellule. À la cathode de platine se
produit la réduction du dioxygène et à l'’anode d’'argent l’'oxydation
de l’'argent. Une membrane de polytétrafluoroéthylène (PTFE),
imperméable au solvant et aux ions mais perméable au dioxygène, sépare
l’'intérieur de la cellule de la solution extérieure étudiée et permet
l’'apport de dioxygène à la cathode. On applique une tension de 700 mV
entre les deux électrodes pour réaliser l’'électrolyse.
Les courbes intensité-potentiel relatives aux deux systèmes étudiés
sont données ci-dessous :
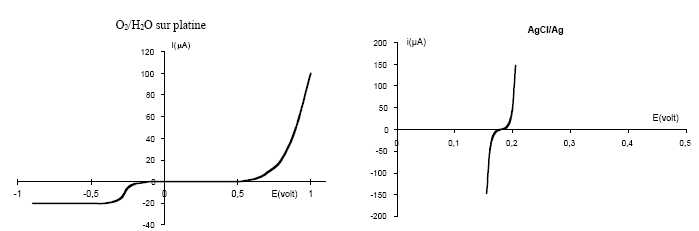
Écrire les équations des réactions anodique et cathodique. Comment évolue le pH dans la cellule ?
Cathode : ½O2 aq+ 2e- +H2O =2HO-aq. Formation de HO-aq, le pH augmente à la cathode.
Anode : Ag(s) +Cl-aq= AgCl(s) + e-.
Définir
le terme «surtension». Que peut-on dire, du point de vue cinétique, de
chacun des systèmes intervenant dans cette électrolyse ?
La
surtension est la différence de tension entre le potentiel de
l'électrode pour un courant d'intensité i et le potentiel de cette
électrode pour un courant nul. Le système O2 /H2O est lent sur électrode de platine. Le système AgCl/ Ag est rapide.
Justifier la valeur choisie pour la tension d’électrolyse à l’aide des courbes intensité-potentiel fournies.
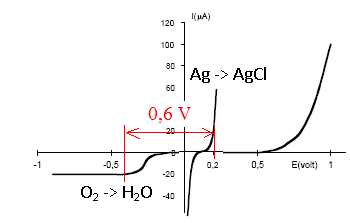
Pourquoi la tension d’électrolyse doit elle rester notablement inférieure à 1 volt ?
On pourrait observer la réduction de l'eau en dihydrogène.
On considère une réaction électrochimique écrite : Red → Ox + n e-.
Définir la vitesse de réaction pour une réaction d’avancement x se déroulant sur une électrode de surface S. Donner la relation entre l’intensité i et la vitesse de réaction.
v = 1/S dx/dt avec dx/dt = i/(nF) ; v = i /(nF S).
Le courant de réduction tend vers une limite. Quelle est l’origine de ce phénomène ? Pourquoi ne l’observe-t-on pas pour les autres branches des deux courbes ?
La vitesse de la réaction de réduction est limitée par la diffusion du dioxygène vers l'électrode.
Il
n'y a pas de transport de matière d'argent car l'électrode est en
argent. Quand à l'ion chlorure, il se trouve en large excès.
L'’intensité du courant limite de réduction a pour expression : i = 4FSDmO2 Km[O2] / dm.
(S est la surface de la cathode, DmO2 et Km sont respectivement le coefficient de diffusion de O2 à travers la membrane et la constante de solubilité de O2 dans la membrane, δm l’épaisseur de la membrane, et [O2] la concentration de la solution extérieure en dioxygène.)
En
déduire la nature de l’étape limitant ici l’intensité du courant. Que
peut-on dire alors de la concentration en dioxygène dans la cellule, en
régime stationnaire ?
L'intensité du courant dépend des
caractéristiques de la membrane ; la diffusion du dioxygène à travers
la membrane est le facteur limitant. La réduction et le transport du
dioxygène dans la cellule sont quant à eux plus rapides. En conséquence
le dioxygène ne peut pas s'accummuler dans la cellule et sa
concentration dans celle-ci reste très faible.
En utilisant la première loi de Fick, proposer une démonstration de l’expression de l’intensité du courant limite.
On fait l'hypothèse d'une diffusion à une dimension en négligeant les effets de bords.
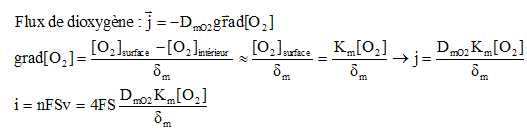
|
.
|
|
La sonde « zircone ».
Il
est souvent nécessaire de mesurer la concentration en dioxygène de
milieux portés à hautes températures (gaz d’échappement, métaux fondus,
etc…). On utilise pour cela la conductivité
ionique de la zircone stabilisée.
La zircone ZrO2 cristallise à très haute température (T ≥ 2370°C) dans une structure de type fluorine CaF2. Dans cette structure, les ions Zr4+ forment un réseau cubique à faces centrées dont
les sites tétraédriques sont occupés par les ions O2-.
Faire
un schéma en perspective de la maille de la zircone et préciser par des
représentations en coupe les positions des différents ions dans la
maille.
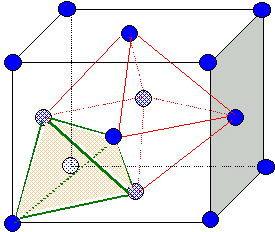 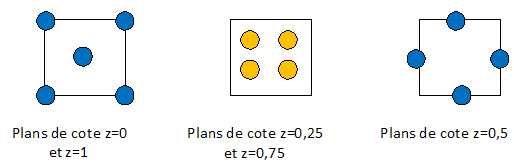 Les ions Zr4+ ocupent les sommets du cube et le centre de chaque face ; les ions O2-occupent les 8 sites tétraèdriques.
Déterminer les coordinences anion/cation et cation/anion.
Chaque anion est au centre d'un tétraèdre dont les sommets sont occupés par quatre cations.
Chaque cation est au centre d'un cube dont les sommets sont occupés par huit anions.
Identifier les sites laissés vacants dans le cristal.
Les sites octaèdriques (Il y en a 4 par maille; ils sont situés au centre de la
maille et aussi au milieu des arètes ) sont inoccupés.
Calculer la masse volumique attendue pour ce solide.
La maille compte 8 anions O2- et 4 cations Zr4+ soit 4 motifs ZrO2.
Masse de la maille m = 4M(ZrO2)/N =4*(91,2 +2*16,0) 10-3 / (6,02 1023) =8,185 10-25 kg.
Volume de la maille V = a3 =(509 10-12)3 = 1,319 10-28 m3.
Masse volumique r = m/V = 8,185 10-25 / (1,319 10-28)~6,21 103 kg m-3.
Rappeler les hypothèses sur lesquelles repose le modèle du cristal ionique parfait.
Lesions
sont des sphères dures. Les ions les plus petits s'insèrent dans les
sites du réseau constitué par les plus gros. Seuls les ions de
signe différent sont en contact.
Déterminer
la valeur minimale que doit prendre, dans ce modèle, le rapport des
rayons ioniques pour que cette structure existe. Commenter le résultat.
Dimension de la grande diagonale du petit carré rouge ( figure
ci-dessous) : d2= (½a)2 + (½2½a)2 ; d = 3½
a/2 .
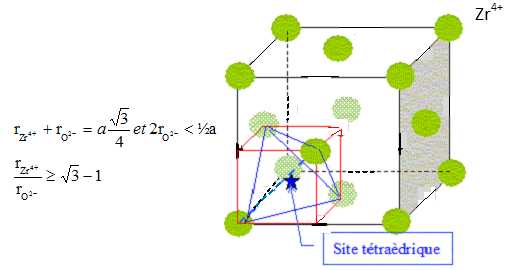
On donne rZr4+ = 84 pm et rO2- = 138 pm. rZr4+ /rO2-
=84/138 ~ 0,61. La condition ci-dessus n'est pas respectée. Le cristal
ne peut pas être décrit par le modèle du crital ionique parfait.
Il est possible de stabiliser cette structure à basse température en y incorporant de 15 à 28% d’oxyde de calcium CaO, l’ion Ca2+ venant occuper dans le cristal la même position que l’ion Zr4+.
On constate alors que le cristal obtenu devient un conducteur ionique.
Montrer que l’introduction de Ca2+ et O2- dans le cristal entraîne la création de lacunes.
En remplaçant Zr4+ +2O2- par Ca2+ + O2-, on créé un déficit en ion oxyde.
Proposer une équation traduisant l’incorporation de CaO au cristal.
CaO ---> Ca2+ + O2- + lacune en Oxyde
Donner une interprétation de la conduction dans ce cristal.
Le nombre de lacunes est égal au nombre d'ion calcium. Les ions oxydes peuvent migrer de lacune en lacune.
|
|
Étude de la sonde.
L’'électrolyte solide sépare deux milieux contenant du dioxygène à différentes pressions. Les électrodes de platine permettent l’'adsorption du dioxygène et les échanges électroniques avec l’'électrolyte. La concentration en dioxygène est déduite de la mesure de la différence de potentiel entre les deux électrodes.
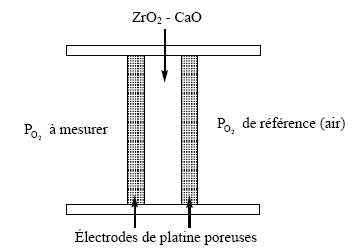
Écrire les équations d’échange électronique à l’anode puis à la cathode.
Oxydation de l'ion oxyde àl'anode : O2- = ½O2 + 2e-.
Réduction du dioxygène à la cathode : ½O2 + 2e- =O2- .
Exprimer la différence de potentiel qui apparaît en fonction de T, PO2 , O2 réf.
E = E°(O2 /O2- ) +RT / (2F) log (PO2½ /(P°½aO2-)).
Eref = E°(O2 /O2- ) +RT / (2F) log (Pref½ /(P°½aO2-)).
Le potentiel chimique de l'ion oxyde étant constant, l'activité de ces ions est égale à l'unité.
E-Eref = RT / (2F) log (PO2½ /Pref½ ).
|
|
|